Prostatacancer
Lynparza (olaparib) är subventionerat av TLV för behandling av kastrationsrestistenta metastatiska prostatacancer patienter med BRCA mutation1.

Lynparza (olaparib) är indicerat som monoterapi för behandling av vuxna patienter med metastaserande kastrationsresistent prostatacancer och BRCA 1/2-mutationer (germline och/eller somatisk) som har progredierat efter nya hormonella läkemedel2.
Tandvårds- och läkemedelsförmånsverket har beslutat att Lynparza från och med den 20 maj 2022 ska ingå i läkemedelsförmånerna och subventioneras som monoterapi för behandling av vuxna patienter med metastaserande kastrationsresistent prostatacancer och BRCA 1/2-mutationer (germline och/eller somatisk) som har progredierat efter nya hormonella läkemedel och där behandling med docetaxel, kabazitaxel och radium-223 gett otillräcklig effekt eller inte är lämplig1.
Europeiska kommissionens godkännande av Lynparza (olaparib) baserades på en undergruppsanalys från PROfound fas III-studien, där olaparib visade en signifikant förbättring av röntgenprogressionsfri överlevnad (rPFS) och total överlevnad (OS) jämfört med enzalutamid eller abirateron hos män med BRCA1/2 mutationer.
Video: PROfound på 3 minuter
Klicka på play för att se filmen
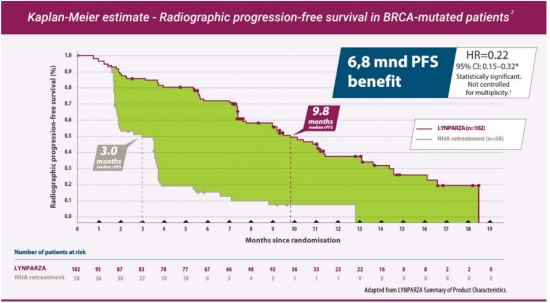
Undergruppsanalysen från fas III-studien PROfound visade att olaparib minskade risken för sjukdomsprogression eller död med 78 % (baserat på en hazard ratio [HR] på 0,22, 95 % konfidensintervall [CI], 0,15-0,32; p ﹤ 0,0001), median rPFS på 9,8 månader jämfört med 3,0 med enzalutamid eller abirateron hos män med mCRPC med BRCA1/2- mutat2.
Olaparib minskade risken för dödsfall med 37 % (baserat på en HR på 0,63, 95 % CI 0,42-0,95) med en median överlevnad (OS) på 20,1 månader jämfört med 14,4 med enzalutamid eller abirateron nominellt statistisk förbättring av OS.*
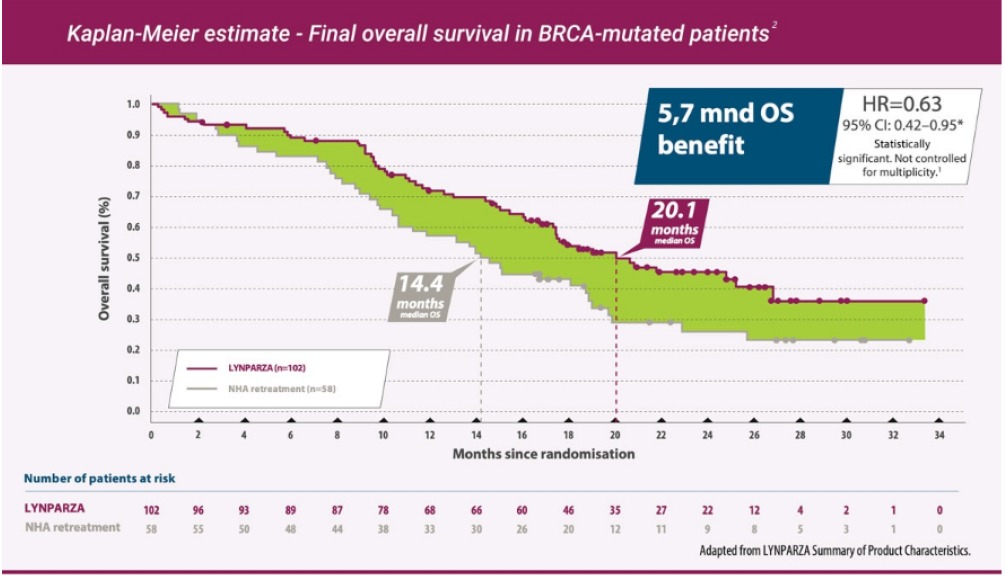
*) Alla patienter i komparatorarm erbjöds olaparib efter sjukdomsprogress, varav 69% av patienterna i kohort A tackade ja och behandlades med Lynparza11
De primära resultaten såväl som överlevnadsresultaten från PROfound publicerades i The New England Journal of Medicine i 20203,4.
De vanligaste biverkningarna i PROfound-studien (större än eller lika med 20 % av patienterna) var anemi (46 %), illamående (41 %), fatigue eller asteni (41 %), minskad aptit (30 %) och diarré (21 %). Biverkningar av grad 3 eller högre var anemi (21 %), fatigue eller asteni (3 %), kräkningar (2 %), urinvägsinfektion (2 %), dyspné (2 %), illamående (1 %), minskad aptit (1 %), ryggsmärtor (﹤1%), diarré (﹤1%) och artralgi (﹤1%)3.**
**) Säkerhetsdata kommer från patienter i cohort A+B i studien, inte bara subpopulationen med BRCA
BRCA mutationer
BRCA1 och BRCA2 är mänskliga gener som producerar proteiner som reparerar skadat DNA och därmed spelar en nyckelroll för att upprätthålla den genetiska stabiliteten hos celler. När någon av dessa gener muteras eller förändras så att den antingen inte producerar protein eller inte fungerar korrekt, kommer DNA-skador inte att repareras tillräckligt och cellerna blir instabila. Som ett resultat kommer cellerna att vara mer benägna för ytterligare genetiska förändringar som leder till cancer och är känsliga för PARP-hämmare, bl.a. olaparib.7-10
PROfound studien
PROfound är en prospektiv, multicenter, randomiserad, öppen fas III-studie som undersöker effektiviteten och säkerheten av olaparib kontra enzalutamid eller abirateron hos patienter med mCRPC som har gått vidare till tidigare NHA-behandling (abirateron eller enzalutamid) och som har en cancermutation i BRCA1/2, ATM eller en av 12 andra gener involverade i signalvägen för homolog rekombinationsreparation (HRR). Studien utformades för att analysera patienter med HRR-genmutationer i två kohorter: det primära effektmåttet var rPFS hos patienter med mutationer i BRCA1/2 eller ATM om olaparib visade klinisk effekt, sedan utfördes en formell analys på alla patienter i studien med en HRR-genmutation (BRCA1/2, ATM, CDK12 och 11 andra HRR-genmutationer). AstraZeneca och MSD meddelade i augusti 2019 att studien uppnådde primär endpoint rPFS.
Lynparza (olaparib)
PARP-hämmaren olaparib är en målinriktad behandling som blockerar DNA-skaderespons (DDR) i celler/tumörer som har en brist på HRR, såsom mutationer i BRCA1 och/eller BRCA2. Hämning av PARP med olaparib gör att PARP-meddelandet till enkelsträngat DNAbrott fastnar och blockerar reproduktionen ytterligare. Resultatet är dubbelsträngat DNAbrott och så småningom celldöd. Olaparib testas i ett antal PARP-beroende tumörtyper med brister och beroende av en fungerande DDR-signalväg. Lynparza, utvecklat och kommersialiserat i ett samarbete mellan AstraZeneca och MSD, och har använts vid behandling av över 30 000 patienter världen över. AZ och MSD arbetar tillsammans för att bättre förstå hur det kan påverka PARP-beroende tumörer som monooch/ eller i kombinationsbehandling inom flera olika cancerområden.
Strategiskt samarbete mellan AstraZeneca och MSD inom onkologi
AstraZeneca och Merck & Co., Inc., Rahway, NJ, USA, känd som MSD utanför USA och Kanada, tillkännagav i juli 2017 ett globalt strategiskt onkologisamarbete för att gemensamt utveckla och kommersialisera Lynparza. De två företagen kommer att arbeta tillsammans för att utveckla Lynparza som monoterapi och i kombination med andra potentiella nya läkemedel. Företagen kommer självständigt att utveckla Lynparza i kombination med sina respektive PD-L1- och PD-1-läkemedel.
AstraZeneca
AstraZeneca är ett globalt, innovationsdrivet, biofarmaceutiskt företag med fokus på forskning, utveckling och marknadsföring av receptbelagda läkemedel, främst för behandling av sjukdomar inom tre terapeutiska områden: luftvägssjukdomar, cancer, hjärtkärlsjukdomar, njursjukdomar och metabola sjukdomar. AstraZeneca är verksamt i över 100 länder och dess innovativa läkemedel används av miljontals patienter världen över.
Referenser
- Lynparza tabletter ingår i högkostnadsskyddet för ytterligare en patientgrupp – Tandvårds- och läkemedelsförmånsverket TLV
- Produktresume för Lynparza (olaparib), www.fass.se
- de Bono J et al. Olaparib for metastatic castration-resistant prostate cancer. N Engl J Med. 2020;382(22):2091–2102.
- Hussain M et al. Survival with olaparib in metastatic castration-resistant prostate cancer. N Engl J Med. 2020. doi: 10.1056/NEJMoa2022485.
- Bray et al. (2018). Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians, 68(6), pp.394-424.
- Cancer.Net. (2014). Treatment of metastatic castration-resistant prostate cancer. Available at: https://www.cancer.net/research-and-advocacy/asco-care-and-treatment-recommendationspatients/treatment-metastatic-castration-resistant-prostate-cancer. [Accessed September 2020]
- Kirby, M. (2011). Characterising the castration-resistant prostate cancer population: a systematic review. International Journal of Clinical Practice, 65(11), pp.1180-1192.
- Wu J, et al. (2010) The role of BRCA1 in DNA damage response. Protein Cell. 2010;1(2):117-123.
- Roy R, et al. (2011). BRCA1 and BRCA2: different roles in a common pathway of genome protection. Nat Rev Cancer. 2011;12(1):68-78. Published 2011 Dec 23. doi:10.1038/nrc3181.
- Gorodetska I, et al. (2019). BRCA Genes: The Role in Genome Stability, Cancer Stemness and Therapy Resistance. J Cancer. 2019;10(9):2109-2127.
- Evans et al. Exploring the Impact of Treatment Switching on Overall Survival from the PROfound Study in Homologous Recombination Repair (HRR)-Mutated Metastatic Castration-Resistant Prostate Cancer (mCRPC). Target Oncol. 2021 Sep;16(5):613-623
Lynparza (olaparib) Antineoplastiska läkemedel, övriga antineoplastiska läkemedel, PARP-hämmare. ATC-kod: L01XK01 Filmdragerade tabletter 100 och 150 mg. Rx.
Filmdragerade tabletter 100 och 150 mg.
Indikationer:
Äggstockscancer:
1) Lynparza tabletter är indicerade som monoterapi för underhållsbehandling av vuxna patienter med avancerad (FIGO stadie III och IV) BRCA1/2-muterad (nedärvd och/eller somatisk) höggradig epitelial ovarial-, tubar- eller primär peritonealcancer som är i respons (komplett eller partiell) efter avslutad första linjens platinumbaserad cytostatikabehandling.
(F) = ingår i förmånen med begränsning, subventioneras vid ovanstående indikation.
2) Lynparza tabletter i kombination med bevacizumab är indicerade som underhållsbehandling av vuxna patienter med avancerad (FIGO stadie III och IV) höggradig epitelial ovarial-, tubar- eller primär peritonealcancer som är i respons (komplett eller partiell) efter avslutad första linjens platinumbaserad cytostatikabehandling i kombination med bevacizumab och vars cancer är associerad med en positiv status för defekt homolog rekombination (HRD) som definieras antingen av en BRCA1/2-mutation och/eller genomisk instabilitet.
(F) = ingår i förmånen med begränsning, subventioneras vid ovanstående indikation.
3) Lynparza tabletter är indicerade som monoterapi för underhållsbehandling av vuxna patienter med platinumkänslig recidiverande höggradig epitelial ovarial-, tubar- eller primär peritonealcancer och som är i respons (komplett eller partiell) efter platinumbaserad cytostatikabehandling.
EF = Ingår inte i förmånen.
Bröstcancer:
1) Lynparza tabletter är indicerade som monoterapi för behandling av vuxna patienter med medfödd BRCA1/2‑mutation som har HER2‑negativ lokalt avancerad eller metastaserad bröstcancer. Patienter ska tidigare ha behandlats med en antracyklin och en taxan som (neo)adjuvant behandling eller som behandling för metastaserad sjukdom, såvida inte patienterna var olämpliga för dessa behandlingar. Patienter med hormonreceptor (HR)‑positiv bröstcancer ska också ha progredierat under eller efter tidigare endokrin behandling eller anses olämpliga för endokrin behandling.
EF = Ingår inte i förmånen.
2) Lynparza tabletter är indicerade som monoterapi eller i kombination med endokrin terapi som adjuvant behandling av vuxna patienter med nedärvd BRCA1/2-mutation som har HER2-negativ tidig bröstcancer med hög risk som tidigare behandlats med neoadjuvant eller adjuvant kemoterapi.
EF = Ingår inte i förmånen.
Adenokarcinom i pankreas:
Lynparza tabletter är indicerade som monoterapi för underhållsbehandling av vuxna patienter med nedärvda BRCA1/2‑mutationer som har metastaserande adenokarcinom i pankreas och som inte har progredierat efter minst 16 veckors platinumbehandling inom en första linjens cytostatikaregim.
EF = Ingår inte i förmånen.
Prostatacancer:
1) Lynparza tabletter är indicerade som monoterapi för behandling av vuxna patienter med metastaserande kastrationsresistent prostatacancer och BRCA1/2-mutationer (nedärvd och eller somatisk) som har progredierat efter tidigare behandling som inkluderade typen nya hormonella läkemedel.
(F) = Ingår i förmånen med begränsning, subventioneras vid ovanstående indikation och där behandling med docetaxel, kabazitaxel och radium-223 gett otillräcklig effekt eller inte är lämplig
2) Lynparza tabletter i kombination med abirateron och prednison eller prednisolon för behandling av vuxna patienter med mCRPC hos vilka kemoterapi inte är kliniskt indicerad
EF = Ingår inte i förmånen.
Dosering: Behandling med Lynparza ska initieras och övervakas av läkare med erfarenhet av cancerläkemedel.
Kontraindikationer: Överkänslighet mot den aktiva substansen eller mot något hjälpämne. Amning under behandlingen och 1 månad efter den sista dosen.
Varningar och försiktighet:
Lynparza får inte användas under graviditet.
Hematologisk toxicitet: Provtagning vid initiering av behandlingen och därefter månatliga kontroller av fullständig blodstatus rekommenderas under de första 12 behandlingsmånaderna och därefter med jämna mellanrum. Om en patient får allvarlig hematologisk toxicitet eller är beroende av blodtransfusioner, ska behandlingen med Lynparza avbrytas och lämpliga blodtester göras.
Myelodysplastiskt syndrom/akut myeloisk leukemi: Om MDS/AML misstänks ska patienten remitteras till en hematolog för vidare utredning, inklusive benmärgsanalys och blodprovtagning för cytogenetik. Om MDS/AML bekräftas efter utredning avseende långvarig hematologisk toxicitet ska Lynparza sättas ut och patienten ska erhålla lämplig behandling.
Senaste översyn av Produktresumén: 2023-03-30
För ytterligare information och priser se www.fass.se.
AstraZeneca AB, 151 85 Södertälje tel: 08 – 553 260 00. www.astrazeneca.se
