Innovativt samarbete för bättre vård av patienter med avancerad njurcancer: MSD Sverige och Elekta Kaiku Health
MSD Sverige och Elekta Kaiku Health utvecklar en digital modul för patienter med avancerad njurcancer.

KEYTRUDA® (pembrolizumab) sex veckors-doseringsschema kan vara ett praktiskt val för både patienter och läkare.
Att dubblera dosen och intervallet och administrera 400 mg var sjätte vecka i stället för 200 mg var tredje vecka, innebär färre sjukhusbesök för patienten – nio infusioner per år (52 veckor/6 = 8,66) vid behandling i monoterapi eller i kombination med tablettbehandling. KEYTRUDA® ges, oavsett om det gäller Q3W- eller Q6W-schemat, som en intravenös infusion under 30 minuter.1
Färre sjukhusbesök kan innebära större bekvämlighet för patienter, särskilt för dem som måste resa långväga till sjukhuset (t.ex. lägre transportkostnad, färre dagar borta från hemmet eller arbetet) samt en minskning av tiden som patienten tillbringar på sjukhuset.2
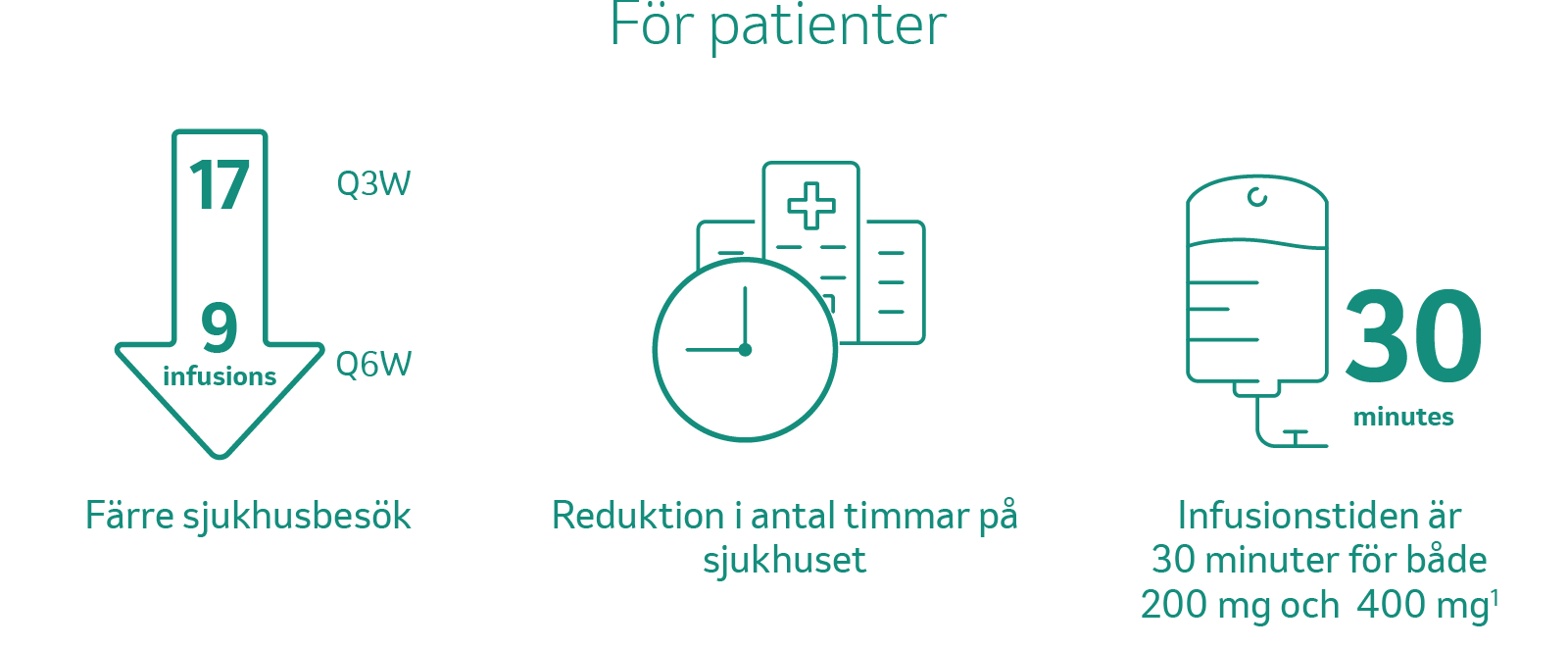
Källa: KEYTRUDA® SPC och Lala et al. 20201,2
Kemisk och fysikalisk stabilitet har visats i upp till 42 dagar vid 2 °C–8 °C eller vid 23 °C–27 °C.
Ur mikrobiologisk synvinkel bör produkten användas omedelbart efter spädning. Den utspädda
lösningen får ej frysas. Om lösningen inte används omedelbart, har användaren ansvar för
förvaringstiden och förvaringsförhållanden innan användning. Förvaringstiden ska normalt inte vara längre än 7 dagar vid 2 °C–8 °C, eller 12 timmar vid rumstemperatur, med undantag om spädningen har skett under kontrollerade, validerade och aseptiska förhållanden. Kylförvarade injektionsflaskor och/eller infusionspåsar måste anta rumstemperatur innan användning.1
Data till stöd för KEYTRUDA® 400 mg Q6W-doseringsschema är baserade på plasmakoncentrationsanalyser.2 Exponerings-responsanalyser används allmänt för att utvärdera säkerhet och effektivitet för olika doseringsscheman.3 Modellbaserade utvärderingar har visat att toxicitetsnivåerna var acceptabla, och den högre doskoncentrationen innebar inga extra säkerhetsproblem.4
Säkerheten för KEYTRUDA® 400 mg Q6W-doseringsschema undersöktes genom att jämföra förutsedda topp- (maximum) plasmakoncentrationer (Cmax) vid jämviktstillstånd med värdena för de initialt godkända doserna (2 mg/kg Q3W och 200 mg Q3W) samt 10 mg/kg varannan vecka, vilket är den högsta kliniskt administrerade dosen. Under hela doseringsintervallet låg koncentrationerna vid 400 mg Q6W långt under dem för 10 mg/kg Q2W. 10 mg/kg Q2W-schemat har uppvisat en snarlik säkerhetsprofil jämfört med de godkända 200 mg- och 2 mg/kg Q3W-doserna.2
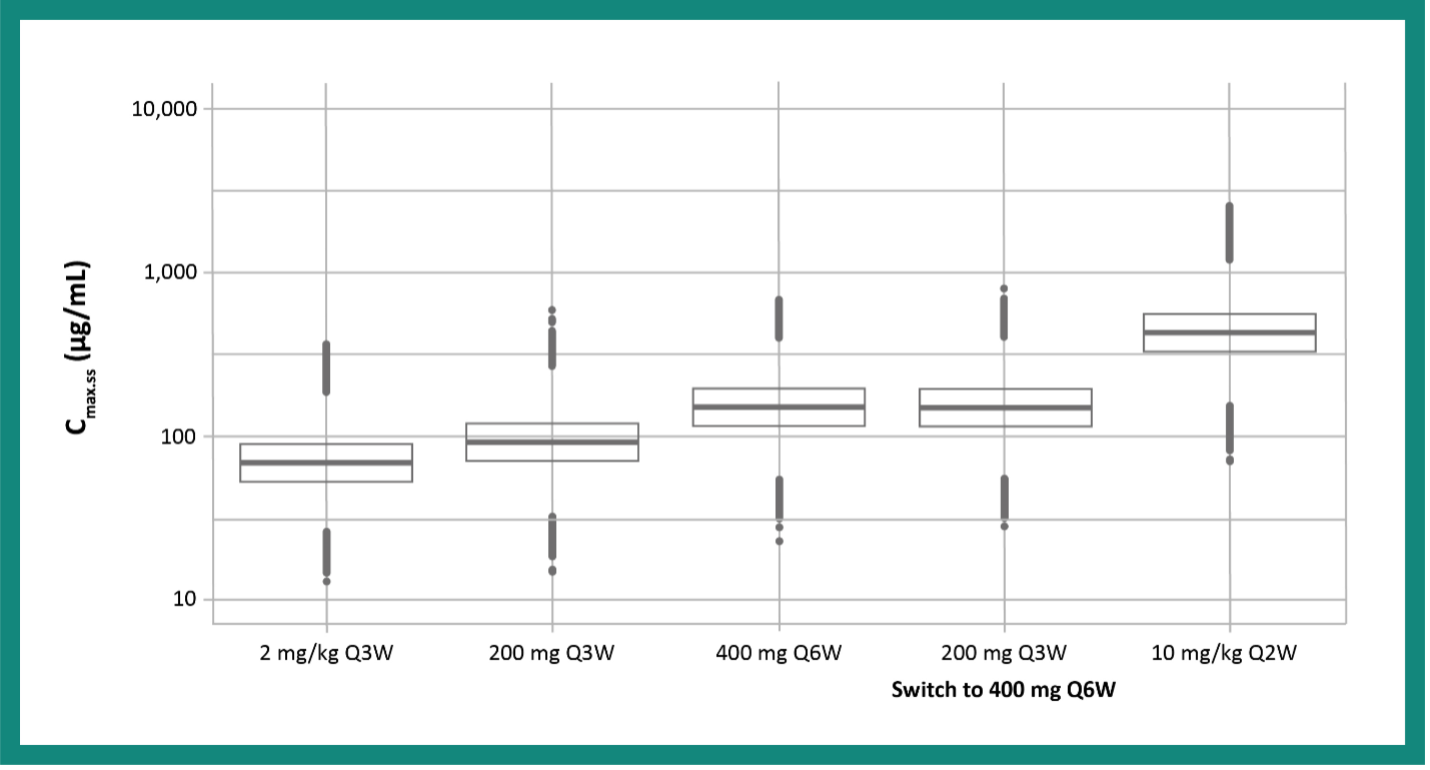
Figur 1: Topp-plasmakoncentrationsprofiler för KEYTRUDA® i olika doser och intervall14
I farmakokinetiska simuleringar ligger topp-plasmakoncentrationen (Cmax) för 400 mg var sjätte vecka långt under 10 mg/kg Q2W-schemat (och inom intervallet för kliniskt uppmätta koncentrationer).
Anpassat från Lala M. et al. 201814
Viktbaserad, snarare än fast dosering har genererat högre plasmakoncentration hos vissa patienter.4 I KEYNOTE-010, en randomiserad fas 2/3-studie, administrerades KEYTRUDA® med 2 mg/kg eller 10 mg/kg var tredje vecka (Q3W). Även med den höga dosen (10 mg/kg) och en maximal plasmakoncentration som avsevärt översteg 400 mg Q6W-schemat, var biverkningar av KEYTRUDA 10 mg/kg* Q3W hanterbara (se tabell 1 för vanliga biverkningar).1,4 I en sammanslagen analys med kliniska säkerhetsdata tillgängliga för 2799 patienter med melanom eller NSCLC, var förekomsten av eventuella biverkningar (20-22 %) och biverkningar av grad 3-5 (5-6 %) enhetlig över de olika doseringsschemana.2 *Doseringen är inte godkänd.
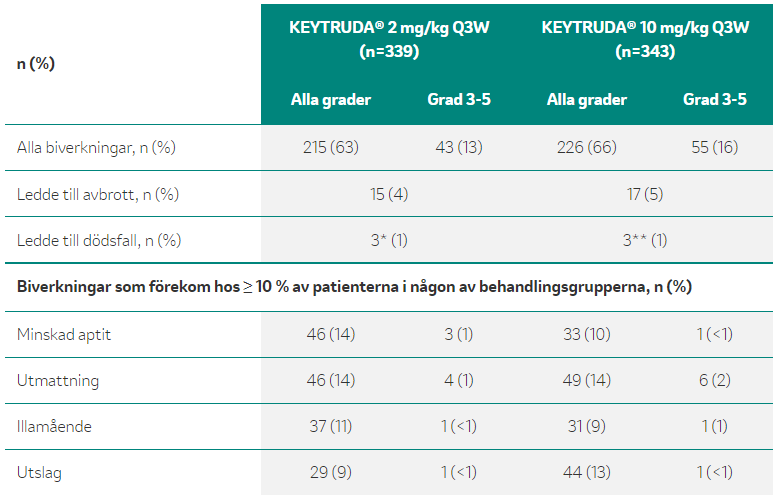
*2 fall av pneumonit och 1 fall av lunginflammation, **1 fall vardera av hjärtinfarkt, lunginflammation och pneumonit
Baserad på data från Herbst R. S. et al. 2016; tabell 2
Vårdpersonal kan även överväga sex veckors-doseringsschemat för KEYTRUDA® även nu när COVID-19-pandemisituationen är över. De nämnda fördelarna med KEYTRUDA® Q6W-doseringsschema som ger ökad bekvämlighet för patienter, minskade kostnader för sjukhus och större flexibilitet för sjukhuspersonal samt det faktum att det inte finns några extra säkerhetsproblem, talar för att använda detta doseringsschema som ett permanent alternativ.
Telefonuppföljning har potential att vara ett effektivt och innovativt sätt att övervaka patientens hälsoutfall. Mellan de fysiska besöken kan patienten ringa till en telefonsvarare och rapportera eventuella biverkningar eller andra orosmoln. Om det uppstått komplikationer följer en sjuksköterska upp ärendet med patienten via telefon. Denna process låter läkaren följa patientens behandlingsförlopp.
Laboratorietester varannan eller var tredje vecka kan bidra till att spåra avvikande resultat. Dessa kan göras hos patientens husläkare eller på vårdcentralen och utgör ett smidigare alternativ för patienten.
Telemedicin: Videokonsultationer kan vara till hjälp för att följa upp patienter mellan de glesare sjukhusbesöken, och då kan patienten ta upp eventuella orosmoln gällande läkemedelshantering, biverkningar eller allmänna frågor gällande behandlingen. Virtuella konsultationer erbjuder ett sätt att få tillgång till tidsläglig vård på ett mycket bekvämt sätt för patienten.
KEYTRUDA® (pembrolizumab) är en humaniserad monoklonal antikropp som binder till PD-1-receptorer. KEYTRUDA® potentierar T-cellsvaret genom att blockera bindningen av PD-1 till PD-L1 och PDL2, vilka uttrycks på antigenpresenterande celler och kan uttryckas av tumörceller eller andra celler i tumörens mikromiljö.1 Monoklonala antikroppar som är målinriktade på immunkontrollpunkter kan återställa anti-tumörimmunitet och därmed upphäva immunflyktmekanismen eller undvikandet av immunsvaret och främja tumörcelldöd.6

MSD Sverige och Elekta Kaiku Health utvecklar en digital modul för patienter med avancerad njurcancer.

Röda Stolen-Initiativet på MSD påminner oss om att alltid sätta patienten först – en symbol för patientens röst och vårt fokus på bättre vård.

Den första och enda ADJUVANTA behandlingen som visat överlevnadsfördel för patienter med NJURCANCER som hade ökad risk för återfall efter
KEYTRUDA® (pembrolizumab); 25 mg/ml koncentrat till infusionsvätska, lösning. Antineoplastiska medel, PD-1/PDL-1-hämmare, L01FF02, Rx, Subventioneras ej, SPC 04/2025
Indikationer:
Melanom
Icke-småcellig lungcancer (NSCLC)
KEYTRUDA i kombination med platinabaserad kemoterapi som neoadjuvant behandling, och därefter fortsatt som monoterapi för adjuvant behandling, är indicerat för behandling av resektabel icke småcellig lungcancer hos vuxna med hög risk för recidiv.
KEYTRUDA som monoterapi är indicerat för behandling av vuxna patienter med:
KEYTRUDA som kombinationsbehandling är indicerat för vuxna patienter med:
Malignt pleuramesoteliom (MPM)
Klassiskt Hodgkins lymfom (cHL)
Urotelial cancer (UC)
Skivepitelcancer i huvud och hals (HNSCC)
Njurcellscancer (RCC)
Cancer som uppvisar hög mikrosatellitinstabilitet (MSI-H) eller defekt mismatch repair (dMMR)
Kolorektalcancer (CRC)
KEYTRUDA som monoterapi är indicerat för vuxna med CRC som uppvisar MSI-H eller dMMR i följande behandlingslinjer:
Icke-kolorektal cancer
KEYTRUDA som monoterapi är indicerat för behandling av följande tumörer som uppvisar MSI-H eller dMMR hos vuxna med:
Esofaguscancer
Trippelnegativ bröstcancer (TNBC)
Endometriecancer (EC)
Cervixcancer
Adenokarcinom i ventrikel eller gastroesofageala övergången
Gallvägscancer
Dosering och administreringssätt: Behandling ska initieras och övervakas av specialistläkare med erfarenhet av cancerbehandling. Om PD-L1-uttrycket specificeras i indikationen ska patienturvalet för behandling med KEYTRUDA baseras på tumöruttrycket av PD-L1, vilket bekräftas med en validerad testmetod. Om specificerat i indikationen ska patienturvalet för behandling med KEYTRUDA baseras på tumörstatus avseende MSI-H/dMMR, vilket bör bekräftas med en validerad testmetod.
Den rekommenderade dosen av KEYTRUDA för vuxna är antingen 200 mg var 3:e vecka eller 400 mg var 6:e vecka administrerat som en intravenös infusion under 30 minuter.
Den rekommenderade dosen av KEYTRUDA som monoterapi för pediatriska patienter från 3 år med cHL eller för patienter från 12 års ålder med melanom är 2 mg/kg kroppsvikt (upp till maximal dos på 200 mg), var 3:e vecka administrerat som en intravenös infusion under 30 minuter.
Patienter bör behandlas med KEYTRUDA till dess att sjukdomsprogression eller oacceptabel toxicitet inträffar (och upp till maximal behandlingstid om det är specificerat för en indikation). Det rekommenderas att kliniskt stabila patienter med initialt tecken på sjukdomsprogression ska stå kvar på behandling till dess att sjukdomsprogress har bekräftats.
För adjuvant behandling av melanom, NSCLC eller RCC ska KEYTRUDA administreras till och med sjukdomsrecidiv, oacceptabel toxicitet eller maximalt under ett års tid.
För neoadjuvant och adjuvant behandling av resektabel NSCLC ska patienter behandlas neoadjuvant med kemoterapi i kombination med 4 doser KEYTRUDA 200 mg var 3:e vecka, eller 2 doser med 400 mg var 6:e vecka, eller till sjukdomsprogression som omöjliggör komplett resektion, eller oacceptabel toxicitet. Detta följs av adjuvant behandling med 13 doser KEYTRUDA 200 mg som monoterapi var 3:e vecka, eller 7 doser 400 mg var 6:e vecka, eller till recidiv eller oacceptabel toxicitet. Patienter med sjukdomsprogression som omöjliggör komplett resektion eller som får oacceptabel toxicitet relaterat till KEYTRUDA i kombination med kemoterapi vid neoadjuvant behandling ska inte få KEYTRUDA som monoterapi för adjuvant behandling.
För neoadjuvant och adjuvant behandling av TNBC ska patienter behandlas neoadjuvant i med kemoterapi i kombination med 8 doser KEYTRUDA 200 mg var 3:e vecka eller 4 doser med 400 mg var 6:e vecka eller till sjukdomsprogression som omöjliggör komplett resektion eller oacceptabel toxicitet. Detta följs av adjuvant behandling med 9 doser KEYTRUDA 200 mg var 3:e vecka eller 5 doser KEYTRUDA 400 mg var 6:e vecka som monoterapi eller till recidiv eller oacceptabel toxicitet. Patienter med sjukdomsprogression som omöjliggör komplett resektion eller som får oacceptabel toxicitet relaterat till KEYTRUDA i kombination med kemoterapi vid neoadjuvant behandling ska inte få KEYTRUDA som monoterapi för adjuvant behandling.
För lokalt avancerad cevixcancer ska patienter behandlas med KEYTRUDA i kombination med radiokemoterapi, följt av KEYTRUDA som monoterapi. KEYTRUDA kan administreras som antingen 200 mg var 3:e vecka eller 400 mg var 6:e vecka, till sjukdomsprogression, oacceptabel toxicitet eller i upp till 24 månader.
Vid administrering av KEYTRUDA som en del av en kombinationsbehandling med intravenös kemoterapi ska KEYTRUDA administreras först. Se även förskrivningsinformationen för kemoterapierna och övriga läkemedel som administreras i kombination med KEYTRUDA.
Vid administrering av KEYTRUDA som en del av en kombinationsbehandling med enfortumab vedotin ska KEYTRUDA administreras efter enfortumab vedotin när det ges samma dag.
Behandling med KEYTRUDA ska sättas ut permanent vid följande tillstånd:
Vid användning i kombination med lenvatinib ska ett eller båda läkemedlen avbrytas vid behov. Lenvatinib ska pausas, dosreduceras eller sättas ut i enlighet med förskrivningsinformationen för lenvatinib vid kombination med KEYTRUDA. Ingen dosreducering rekommenderas för KEYTRUDA.
Kontraindikationer: Överkänslighet mot den aktiva substansen eller mot något hjälpämne.
Varningar och försiktighet: För påvisande av tumörens PD-L1-uttryck är det viktigt att välja en validerad och robust metod för att minimera antalet falskt negativa eller falskt positiva utfall.
De flesta immunmedierade biverkningar som förekom under behandling med KEYTRUDA var reversibla och hanterades med uppehåll i behandlingen med KEYTRUDA, administrering av kortikosteroider och/eller understödjande behandling. Immunmedierade biverkningar har också debuterat efter den sista dosen av KEYTRUDA.
För biverkningar som misstänks vara immunmedierade bör lämplig utvärdering utföras för att bekräfta etiologin eller utesluta andra orsaker. För patienter vars immunmedierade biverkningar inte kunde kontrolleras med kortikosteroider kan, baserat på begränsade data från kliniska studier, andra systemiska immunsuppressiva läkemedel övervägas. Immunmedierade biverkningar som förekommit i samband med behandling inkluderar pneumonit, kolit, hepatit, nefrit och endokrinopatier.
Långvarig hormonell substitutionsbehandling kan vara nödvändig i fall av immunmedierade endokrinopatier. Allvarliga immunmedierade hudbiverkningar har rapporterats hos patienter som fått KEYTRUDA. Fall av SJS och TEN, vissa med dödlig utgång, har rapporterats hos patienter som fått KEYTRUDA. Om SJS eller TEN bekräftas ska KEYTRUDA sättas ut permanent. Ytterligare kliniskt signifikanta, immunmedierade biverkningar, inklusive allvarliga fall och fall med dödlig utgång, har rapporterats i kliniska studier eller efter godkännandet. Fall av graft-versus-host disease (GVHD) och hepatisk venös ocklusiv sjukdom (VOD) har observerats hos patienter med cHL som genomgått allogen hematopoetisk stamcellstransplantation (HSCT) efter tidigare exponering för KEYTRUDA.
Avstötning av organtransplantat har rapporterats efter godkännandet för försäljning hos patienter som behandlas med PD-1-hämmare. Behandling med KEYTRUDA kan öka avstötningsrisken hos organtransplanterade patienter.
Hos patienter som genomgått allogen HSCT har akut GVHD, inklusive GVHD med dödlig utgång, rapporterats efter behandling med KEYTRUDA. Till dess att ytterligare data blir tillgänglig, bör noggrant övervägande av de potentiella fördelarna med HSCT och den eventuella ökade risken för transplantationsrelaterade komplikationer göras från fall till fall.
Allvarliga infusionsrelaterade reaktioner, inklusive överkänslighetsreaktioner och anafylaxi, har rapporterats hos patienter som behandlats med KEYTRUDA.
KEYTRUDA i kombination med kemoterapi ska användas med försiktighet till patienter ≥ 75 år efter noggrant övervägande av det potentiella nytta-riskförhållandet på individuell basis. För användning av KEYTRUDA som adjuvant behandling av patienter med melanom har en trend mot ökad frekvens av svåra och allvarliga biverkningar hos patienter ≥ 75 år har observerats. Säkerhetsdata för KEYTRUDA som adjuvant behandling av patienter ≥ 75 år med melanom är begränsade.
Vid urotelial cancer ska läkaren innan insättning av behandling överväga den fördröjda effekten av KEYTRUDA hos patienter med sämre prognos som tidigare behandlats med platinabaserad kemoterapi. Vid användning av KEYTRUDA i kombinationsbehandling för patienter med NSCLC och HNSCC är de observerade biverkningsfrekvenserna högre, vilket speglar bidragen från var och en av komponenterna.
När KEYTRUDA ges med axitinib, har högre frekvenser än väntat rapporterats av förhöjda ALAT och ASAT av grad 3 och 4 hos patienter med avancerad RCC. Det saknas direkt jämförande studier av säkerheten för KEYTRUDA i kombinationsbehandling mot KEYTRUDA som monoterapi.
Kolangit och gallvägsrelaterade infektioner är inte ovanligt hos patienter med gallvägscancer. Patienter med gallvägscancer (speciellt de med stent i gallvägarna) ska därför undersökas för utveckling av kolangit eller gallvägsinfektion innan behandling påbörjas och regelbundet därefter.
Patientkort: Alla förskrivare av KEYTRUDA måste vara insatta i förskrivarformationen och behandlingsriktlinjerna avseende KEYTRUDA.
Förskrivaren måste diskutera riskerna med KEYTRUDA-behandling med patienten. Patienten ska förses med ett patientkort i samband med varje förskrivning.
Särskilda patientgrupper: Äldre; Ingen dosjustering behövs för patienter ≥ 65 år. Nedsatt njurfunktion; Ingen dosjustering behövs för patienter med lätt eller måttligt nedsatt njurfunktion. KEYTRUDA har inte studerats hos patienter med svårt nedsatt njurfunktion. Nedsatt leverfunktion; Ingen dosjustering behövs för patienter med lätt eller måttligt nedsatt leverfunktion. KEYTRUDA har inte studerats hos patienter med svårt nedsatt leverfunktion. Pediatrisk population; Säkerhet och effekt för KEYTRUDA för barn under 18 år har inte fastställts med undantag för pediatriska patienter med melanom eller cHL.
Biverkningar: KEYTRUDA förknippas oftast med immunmedierade biverkningar. De flesta av dessa, inklusive allvarliga biverkningar, gick i regress efter initiering av lämplig medicinsk behandling eller utsättande av KEYTRUDA.
Säkerheten för KEYTRUDA som monoterapi har utvärderats hos 7 631 patienter med olika tumörtyper med avseende på fyra doser (2 mg/kg kroppsvikt var 3:e vecka, 200 mg var 3:e vecka eller 10 mg/kg kroppsvikt varannan eller var 3:e vecka) i kliniska studier. I denna patientgrupp var de vanligaste biverkningarna trötthet (31 %), diarré (22 %) och illamående (20 %). Majoriteten av de biverkningar som rapporterades var av grad 1 eller 2 i allvarlighetshetsgrad. De allvarligaste biverkningarna som rapporterades för monoterapi var immunmedierade biverkningar och allvarliga infusionsrelaterade reaktioner.
Säkerheten för KEYTRUDA i kombination med kemoterapi eller radiokemoterapi har utvärderats i kliniska studier omfattande 6334 patienter med olika tumörtyper som fick 200 mg, 2 mg/kg kroppsvikt eller 10 mg/kg kroppsvikt av KEYTRUDA var 3:e vecka. De mest frekvent förekommande biverkningarna var illamående (52 %), anemi (51 %), trötthet (36 %), diarré (35 %), förstoppning (32 %), kräkningar (28 %), sänkt antal neutrofiler
(27 %) och nedsatt aptit (27 %). Incidensen av biverkningar av grad 3-5 hos patienter med NSCLC var 69 % för kombinationsbehandling med KEYTRUDA och 61 % för enbart kemoterapi, för patienter med HNSCC var incidensen 85 % för kombinationsbehandling med KEYTRUDA och 84 % för kemoterapi tillsammans med cetuximab. För patienter med esofaguscancer var incidensen 86 % för kombinationsbehandling med KEYTRUDA och 83 % för enbart kemoterapi, och för patienter med TNBC var incidensen 80 % för kombinationsbehandling med KEYTRUDA och 77 % för enbart kemoterapi. För patienter med cervixcancer var incidensen 77 % för kombinationsbehandling med pembrolizumab (kemoterapi, med eller utan bevacizumab, eller i kombination med radiokemoterapi) och 71 % för kemoterapi med eller utan bevacizumab eller enbart radiokemoterapi. För patienter med ventrikelcancer var incidensen 74 % för kombinationsbehandling med pembrolizumab (kemoterapi med eller utan trastuzumab) och 68 % för kemoterapi med eller utan trastuzumab, och hos patienter med gallvägscancer var incidensen 85 % för kombinationsbehandling med pembrolizumab och 84 % för enbart kemoterapi, för patienter med endometriecancer var incidensen 59 % för kombinationsbehandling med pembrolizumab och 46 % för enbart kemoterapi, och för patienter med malignt pleuramesoteliom var incidensen 44 % för kombinations-behandling med pembrolizumab och 30 % för enbart kemoterapi.
Säkerheten för KEYTRUDA i kombination med axitinib eller lenvatinib vid avancerad RCC har utvärderats i kliniska studier med 1 456 patienter med avancerad RCC eller avancerad EC som fått 200 mg KEYTRUDA var 3:e vecka och antingen 5 mg axitinib två gånger dagligen eller 20 mg lenvatinib en gång dagligen, såsom lämpligt. I dessa patientpopulationer var de mest frekvent förekommande biverkningarna diarré (58 %), hypertoni (54 %), hypotyreos (46 %), trötthet (41 %), nedsatt aptit (40 %), illamående (40 %), artralgi (30 %), kräkningar (28 %), viktnedgång (28 %), dysfoni (28 %), buksmärta (28 %), proteinuri (27 %), palmar-plantar erytrodysestesi (26 %), hudutslag (26 %), stomatit (25 %), förstoppning (25 %), muskuloskeletal smärta (23 %), huvudvärk (23 %) och hosta (21 %). Incidensen av biverkningar grad 3-5 var 80 % för KEYTRUDA i kombination med antingen axitinib eller lenvatinib och 71 % för enbart sunitinib. För patienter med EC var incidensen av biverkningar grad 3-5 89 % för KEYTRUDA i kombination med lenvatinib och 73 % för enbart kemoterapi.
Följande mycket vanliga biverkningar rapporterades för ≥ 1 av 10 patienter:
Monoterapi: anemi, hypotyreos*, minskad aptit, huvudvärk, dyspné, hosta, diarré, buksmärta*, illamående, kräkning, förstoppning, hudutslag*, klåda*, muskuloskeletal smärta*, artralgi, trötthet, asteni, ödem*, pyrexi. Kombination med kemoterapi eller radiokemoterapi: anemi, neutropeni, trombocytopeni, hypotyreos*, hypokalemi, minskad aptit, sömnlöshet, perifer neuropati, huvudvärk, yrsel, dyspné, hosta, diarré, illamående, kräkning, buksmärta*, förstoppning, hudutslag*, alopeci, klåda*, muskuloskeletal smärta*, artralgi, trötthet, asteni, pyrexi, ödem*, förhöjt ALAT/ASAT. Kombination med axitinib eller lenvatinib: infektion i urinvägarna, anemi, hypotyreos, minskad aptit, huvudvärk, förändrad smakuppfattning, hypertoni, dyspné, hosta, diarré, buksmärta*, illamående, kräkning, förstoppning, hudutslag*, klåda*, artralgi, muskuloskeletal smärta*, myosit*, smärta i extremiteter, trötthet, asteni, ödem*, pyrexi, förhöjt lipas, förhöjt ALAT/ASAT, förhöjt blodkreatinin.
Följande vanliga biverkningar rapporterades för 1-10 av 100 patienter:
Monoterapi: lunginflammation, trombocytopeni, neutropeni, lymfopeni, infusionsrelaterad reaktion*, hypertyreos, hyponatremi, hypokalemi, hypokalcemi, sömnlöshet, yrsel, perifer neuropati, letargi, förändrad smakuppfattning, torra ögon, hjärtarytmi inklusive förmaksflimmer, hypertoni, pneumonit*, kolit*, muntorrhet, hepatit*, allvarliga hudreaktioner*, hudrodnad, dermatit, torr hud, vitiligo*, eksem, alopeci, akneliknande utslag, smärta i extremiteter, myosit*, artrit*, influensaliknande symtom, frossa, förhöjt ASAT/ALAT, hyperkalcemi, förhöjda alkaliska fosfataser (ALP), förhöjd nivå av bilirubin i blodet, förhöjt blodkreatinin. Kombination med kemoterapi eller radiokemoterapi: lunginflammation, febril neutropeni, leukopeni, lymfopeni, infusionsrelaterad reaktion*, binjurebarksvikt*, hypertyreos*, tyreoidit*, hyponatremi, hypokalcemi, förändrad smakuppfattning, torra ögon, hjärtarytmi inklusive förmaksflimmer, hypertoni, pneumonit*, kolit*, muntorrhet, gastrit, hepatit*, allvarliga hudreaktioner*, dermatit, hudrodnad, torr hud, akneliknande utslag, eksem, myosit*, smärta i extremiteter, artrit*, akut njurskada, influensaliknande sjukdom, frossa, förhöjd nivå bilirubin i blodet, förhöjt alkaliskt fosfatas (ALP), förhöjt blodkreatinin, hyperkalcemi. Kombination med axitinib eller lenvatinib: lunginflammation, neutropeni, trombocytopeni, lymfopeni, leukopeni, infusionsrelaterad reaktion*, binjurebarksvikt*, hypertyreos, tyreoidit*, hyponatremi, hypokalemi, hypokalcemi, sömnlöshet, yrsel, perifer neuropati, letargi, torra ögon, hjärtarytmi inklusive förmaksflimmer, pneumonit*, kolit*, pankreatit*, gastrit, muntorrhet, hepatit*, allvarliga hudreaktioner*, dermatit, torr hud, hudrodnad, akneliknande utslag, alopeci, artrit*, nefrit*, influensaliknande sjukdom, frossa, förhöjt amylas, förhöjda ALP, hyperkalcemi, förhöjd nivå bilirubin i blodet.
*) Dessa termer representerar en grupp av relaterade händelser som beskriver ett medicinskt tillstånd snarare än en enstaka händelse
När pembrolizumab administreras i kombination med enfortumab vedotin, se produktresumén för enfortumab vedotin innan behandlingen påbörjas.
Säkerheten för pembrolizumab i kombination med enfortumab vedotin har utvärderats hos 564 patienter med inoperabel eller metastaserad urotelial cancer som fick 200 mg pembrolizumab på dag 1 och 1,25 mg/kg enfortumab vedotin på dag 1 och 8 i varje 21-dagarscykel. Totalt sett observerades en högre incidens av biverkningar för pembrolizumab i kombination med enfortumab vedotin än för pembrolizumab som monoterapi, vilket återspeglar bidraget av enfortumab vedotin och den längre durationen av behandlingen med kombinationsbehandlingen. Biverkningarna liknade generellt de som observerats hos patienter som fått pembrolizumab eller enfortumab vedotin som monoterapi. Incidensen av makulopapulära utslag var 36 % av alla grader (10 % grad 3-4), vilket är högre än vad som observerats för pembrolizumab som monoterapi. Generellt var biverkningsfrekvenser högre hos patienter ≥ 65 år jämfört med < 65 år, särskilt för allvarliga biverkningar (56,3 % respektive 35,3 %) och biverkningar ≥ grad 3 (80,3 % respektive 64,2 %), vilket liknande observationerna för kemoterapi-komparatorn.
Immunogenicitet: I kliniska studier med patienter som behandlades med KEYTRUDA 2 mg/kg kroppsvikt var 3:e vecka, 200 mg var 3:e vecka eller 10 mg/kg kroppsvikt varannan eller var 3:e vecka som monoterapi hade 36 (1,8 %) av 2 034 utvärderbara patienter positiva testsvar för behandlingsinducerade antikroppar mot KEYTRUDA, varav 9 (0,4%) patienter hade neutraliserande antikroppar mot KEYTRUDA. Det fanns inga tecken på förändrad farmakokinetisk profil eller säkerhetsprofil vid utveckling av anti- KEYTRUDA eller neutraliserande antikroppar.
Interaktioner: Inga formella farmakokinetiska interaktionsstudier har utförts med KEYTRUDA. Eftersom KEYTRUDA elimineras från cirkulationen genom katabolism förväntas inga metabola läkemedelsinteraktioner. Användning av systemiska kortikosteroider eller immunsuppressiva läkemedel före start av KEYTRUDA bör undvikas på grund av potentiell påverkan på KEYTRUDA:s farmakodynamiska aktivitet och effekt.
Fertilitet, graviditet och amning: Det finns inga data från användning av KEYTRUDA hos gravida kvinnor. KEYTRUDA ska inte användas under graviditet såvida inte kvinnans kliniska tillstånd kräver behandling med KEYTRUDA. Fertila kvinnor ska använda en effektiv preventivmetod under behandling med KEYTRUDA och under minst 4 månader efter den sista dosen av KEYTRUDA. Det är okänt om KEYTRUDA utsöndras i bröstmjölk. Ett beslut bör fattas om man ska avbryta amningen eller avbryta behandling med KEYTRUDA efter att man tagit hänsyn till fördelen med amning för barnet och fördelen med behandling för kvinnan. Inga kliniska data finns tillgängliga avseende eventuella effekter av KEYTRUDA på fertiliteten.
För fullständig information se fass.se
SE-KEY-00106 04/2025

För att se detta innehåll måste du vara kvalificerad sjukvårdspersonal. Arbetar du inom hälso- och sjukvården? Klicka för att bekräfta