Delstrigo och Pifeltro
Delstrigo och Pifeltro – antiviralmedel mot HIV.
Indikation och dosering
Doravirin finns som singelsubstans och som kombinationstablett tillsammans med lamivudin och tenofovirdisoproxil, vilket ger flexibilitet och individuell anpassning:

Delstrigo är avsett för behandling av vuxna som är infekterade med hiv‑1, utan tidigare eller nuvarande tecken på resistens mot NNRTI-läkemedel, lamivudin eller tenofovir. Delstrigo är också avsett för behandling av ungdomar 12 år och äldre som väger minst 35 kg och som är infekterade med hiv‑1 utan tidigare eller i nuläget påvisad resistens mot NNRTI-läkemedel, lamivudin eller tenofovir och som har drabbats av toxicitet som utesluter användning av andra behandlings‑regimer som inte innehåller tenofovirdisoproxil¹

Pifeltro är i kombination med andra antiretrovirala läkemedel, avsett för behandling av vuxna, och ungdomar 12 år och äldre som väger minst 35 kg, som är infekterade med hiv‑1, utan tidigare eller nuvarande tecken på resistens mot NNRTI-läkemedel.²
Flexibel administrering med fokus på patientens behov

Effekt
Effekten av DELSTRIGO och PIFELTRO utvärderades i två 48-veckorsstudier på behandlingsnaiva vuxna patienter med HIV-1: DRIVE-AHEAD och DRIVE-FORWARD. Båda studierna visade:
Effektiv virussuppression oberoende av virusmängd (vid baslinjen)

DELSTRIGO visade non-inferioritet jämfört med EFV/FTC/TDF definierad som HIV-1 RNA <50 kopior/mL, efter 48 veckors behandling (84 % vs 81 %)³
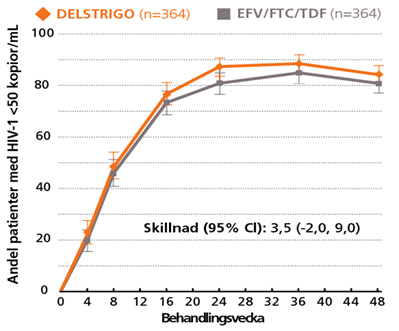
Stratifiering: 3,9
(andel patienter med hiv-1 RNA <50 kopior/ml)
HIV-1 RNA > 100 000 kopior/mL vid baslinjen:
- 81 % Delstrigo
- 81 % EFV/FTC/TDF
Skillnad 1,0 % (95 % CI: -12,4; 14,3)
(Delstrigo N=69; EFV/FTC/TDF N=73)
HIV-1 RNA ≤ 100 000 kopior/mL vid baslinjen:
- 91 % Delstrigo
- 91 % EFV/FTC/TDF
Skillnad -0,5 % (95 % CI: -5,5; 4,4)
(Delstrigo N=277; EFV/FTC/TDF N=258)
Vid vecka 96, visade DELSTRIGO non-inferioritet jämfört med EFV/FTC/TDF, definierad som hiv-1 RNA <50 kopior/ml (77,5 % vs 73,6 %) (Skillnad [95 % CI]: 3,8 [-2,4,10.0])5
CI = konfidensintervall, DRV/r = darunavir/ritonavir, EFV/FTC/TDF = efavirenz/emtricitabine/tenofovir disoproxil fumarate, HIV-1 = humant immunbrist virus typ 1, NRTI = nucleoside reverse transcriptase inhibitor, RNA = ribonucleic acid
Effektiv virussuppression oberoende av virusmängd (vid baslinjen)

PIFELTRO + 2 NRTIs visade non-inferioritet jämfört med DRV/r + 2 NRTIs definierad som HIV-1 RNA <50 kopior/mL, efter 48 veckors behandling (84 % vs 80 %) 4
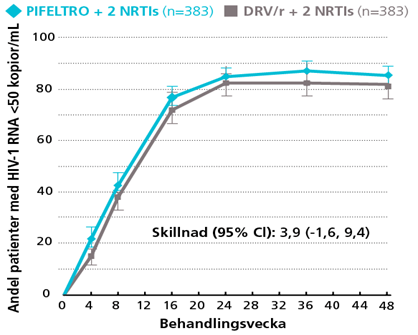
Stratifiering:4,9
(andel patienter med hiv-1 RNA <50 kopior/ml)
HIV-1 RNA > 100 000 kopior/mL vid baslinjen:
- 81 % Pifeltro + 2 NRTIs
- 76 % DRV/r + 2 NRTIs
Skillnad 3 % (95 % CI: -11,2; 17,1)
(Pifeltro + 2 NRTIs N=79; DRV/r + 2 NRTIs N=72)
HIV-1 RNA ≤ 100 000 kopior/mL vid baslinjen:
- 90 % Pifeltro + 2 NRTIs
- 89 % DRV/r + 2 NRTIs
Skillnad 1,5 % (95 % CI: -3,7; 6,8)
(Pifeltro + 2 NRTIs N=285; DRV/r + 2 NRTIs N=282)
Vid vecka 96, visade PIFELTRO +2 NRTIs non-inferioritet jämfört med DRV/r +2 NRTIs, definierad som hiv-1 RNA <50 kopior/mL (73 % vs 66 %) (Skillnad [95 % CI]: 7.1 [0.5, 13.7]) 6
CI = konfidensintervall, DRV/r = darunavir/ritonavir, HIV-1 = humant immunbrist virus typ 1, NRTI = nucleoside reverse transcriptase inhibitor, RNA = ribonucleic acid
Fortsatt effektiv virussuppression efter byte till DELSTRIGO

Delstrigo visade non-inferioritet jämfört med fortsatt behandling på baslinjeregim, definierad som andelen av patienter med HIV-1 RNA <50 kopior/ml⁷
Omedelbar övergång till Delstrigo vecka 48 vs fortsatt ART baslinjeregim vecka 24 (primärt utfallsmått)
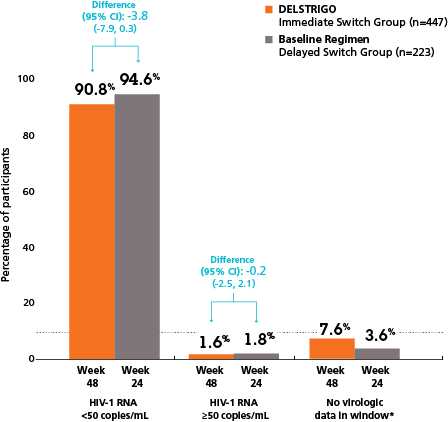
Omedelbar övergång till Delstrigo vecka 24 vs fortsatt ART baslinjeregim vecka 24 (sekundärt utfallsmått)
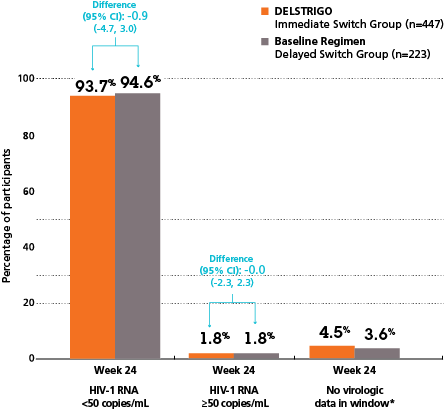
*Statistisk analys gjordes ej
DRIVE AHEAD Studiedesign
DRIVE-AHEAD är en randomiserad, multicenter, dubbelblind, aktivt kontrollerad, non-inferiority fas 3-prövning som utvärderar effekten och säkerheten för Delstrigo. I DRIVE-AHEAD randomiserades 728 behandlingsnaiva vuxna patienter och fick minst en dos av antingen Delstrigo (DOR/3TC/TDF 100/300/245 mg) eller (EFV/FTC/TDF) en gång dagligen i 96 veckor. Den primära utfallsmått var andelen deltagare med <50 HIV-1 RNA-kopior/ml och andel patienter med neuropsykiatriska biverkningar i 3 specificerade kategorier: yrsel, sömnstörningar och förändrat medvetandetillstånd (inkluderar letargi, somnolens, synkope) vid vecka 48. Sekundärt säkerhetsmått var ändringar i baslinjen av fastande LDL kolesterol och non-HDL-kolesterol vid vecka 48.
DRIVE FORWARD Studiedesign
DRIVE-FORWARD är en randomiserad, multicenter, dubbelblind, aktivt kontrollerad, non-inferiority fas 3-prövning för att utvärdera effekten och säkerheten för Pifeltro. I DRIVE-FORWARD randomiserades 766 behandlingsnaiva vuxna patienter och fick minst en dos av antingen Pifeltro (doravirin 100 mg) eller darunavir + ritonavir 800+100 mg en gång dagligen, båda i kombination med emtricitabin/tenofovirdisoproxil (FTC/TDF) eller abakavir/lamivudin (ABC/3TC) enligt prövarens val i 96-veckor. Den primära utfallsmått var andelen deltagare med <50 HIV-1 RNA-kopior / ml vid vecka 48. Sekundärt säkerhetsmått var ändringar i baslinjen av fastande LDL kolesterol och non-HDL-kolesterol vid vecka 48.
DRIVE SHIFT Studiedesign
DRIVE-SHIFT är en randomiserad, aktivt kontrollerad, non-inferiority, öppen fas 3-studie. Effekten av övergång från en baslinjeregim bestående av 2 NRTI i kombination med en ritonavir- eller kobicistat-boostad PI, kobicistat-boostad elvitegravir eller en NNRTI till Delstrigo (DOR/3TC/TDF) utvärderades i DRIVE-SHIFT hos virologiskt supprimerade hiv-1-infekterade vuxna i 48 veckor. Försökspersonerna måste ha varit virologiskt supprimerade (hiv-1 RNA < 40 kopior/ml) på sin baslinjeregim i minst 6 månader före studiestart, utan tidigare virologisk svikt och ha en dokumenterad avsaknad av RT-substitutioner som ger resistens mot doravirin, lamivudin och tenofovir. 670 försökspersoner randomiserades till att antingen byta till Delstrigo vid baslinjen [n=447, gruppen för omedelbar övergång (ISG)], eller fortsätta med sin baslinjeregim fram till vecka 24, vid vilken tidpunkt de bytte till Delstrigo [n=223, gruppen med fördröjd övergång (DSG)]. Primärt utfallsmått var andelen deltagare med hiv-1 RNA <50 kopior/ml vid vecka 48 i gruppen med omedelbar övergång (Immediate Switch Group, ISG) jämfört med vecka 24 i gruppen med fördröjd övergång (Delayed Switch Group, DSG). Sekundärt säkerhetsmått var andelen deltagare med hiv-1 RNA <50 kopior/ml vid vecka 24 i gruppen med omedelbar övergång (Immediate Switch Group, ISG) jämfört med vecka 24 i gruppen med fördröjd övergång (Delayed Switch Group, DSG).
Tolerabilitet och säkerhet
Summering: Vanligaste biverkningarna som ansågs kunna ha ett möjligt eller troligt samband med doravirin var illamående (4 %) och huvudvärk (3 %).1, 2
Behandlingsavbrott på grund av biverkningar3

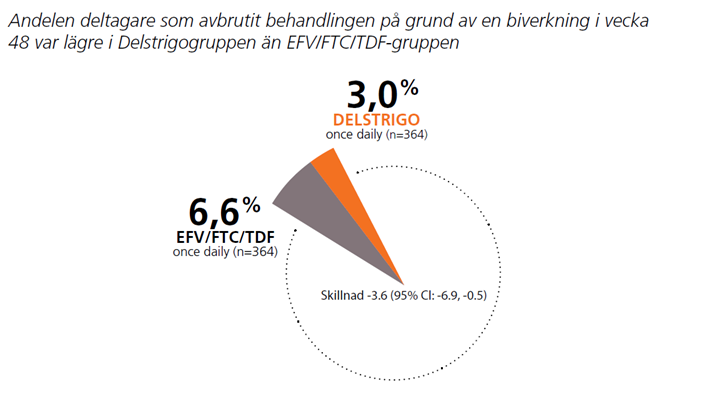
Behandling med ART kan påverka lipidnivåer⁸

Resistens

Notera att Delstrigo är avsett för behandling av vuxna som är infekterade med hiv‑1, utan tidigare eller nuvarande tecken på resistens mot NNRTI-läkemedel, lamivudin eller tenofovir. Delstrigo är också avsett för behandling av ungdomar 12 år och äldre som väger minst 35 kg och som är infekterade med hiv‑1 utan tidigare eller i nuläget påvisad resistens mot NNRTI-läkemedel, lamivudin eller tenofovir och som har drabbats av toxicitet som utesluter användning av andra behandlings‑regimer som inte innehåller tenofovirdisoproxil.
Interaktioner1,2
Samtidig administrering med läkemedel som är starka inducerare av enzymet CYP3A är kontraindicerat eftersom betydande minskning av plasmakoncentrationen av doravirin då förväntas

Doravirin kan administreras samtidigt med flera vanliga läkemedel1,2
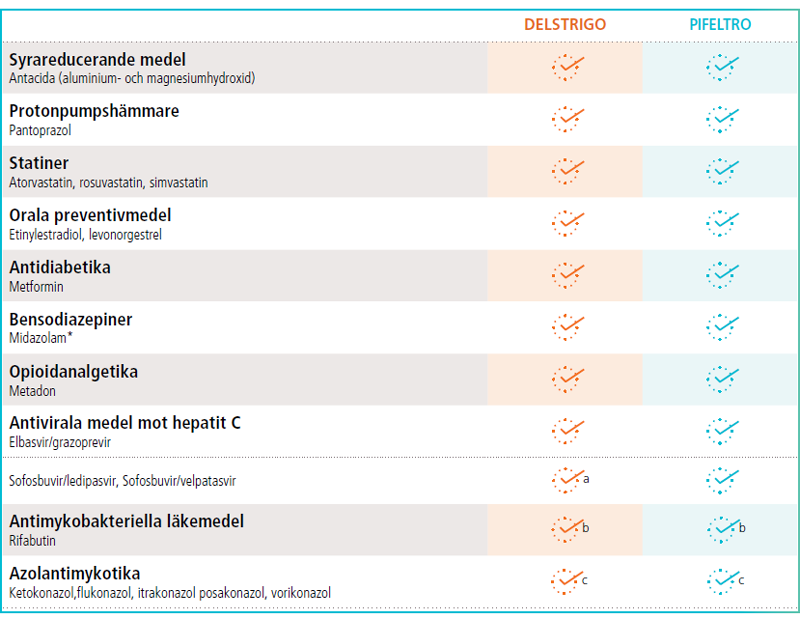
*18 % minskning i exponeringen av midazolam har observerats
a. Monitorering av biverkningar associerad med TDF krävs
b. Om Delstrigo eller Pifeltro administeraras samtidigt med rifabutin, ska dosen doravirin ökas till 100mg två gånger dagligen. Detta genom att lägga till en tablett doravirin 100mg(som enskild substans, Pifeltro) som ska tas ungefär 12 timmar från dosen av Delstrigo eller Pifeltro
c. Användning av Delstrigo eller Pifeltro med azolantimykotika kan orsaka en ökning av doravirin (hämning av CYP3A-enzymer). Ingen dosjustering krävs.
Referenser
- Delstrigo Produktresumé 06/2023
- Pifeltro Produktresumé 07/2023
- Orkin C, Squires K E, Molina JM, et al. Doravirine/Lamivudine/Tenofovir Disoproxil Fumarate is Non-inferior to Efavirenz/Emtricitabine/Tenofovir Disoproxil Fumarate in Treatment-naïve Adults With Human Immunodeficiency Virus-1 Infection: week 48 Results of the DRIVE-AHEAD Trial. Clin Infect Dis 2019 Feb 1; 68(4): 535-544.
- Molina JM, Squires K, Sax P E et al. Doravirine versus ritonavir-boosted darunavir in antiretroviral-naïve adults with HIV-1 (DRIVE-FORWARD): 48-week results of a randomized, double-blind, phase 3, non-inferiority trial. Lancet HIV. 2018;5(5):e211-e220. doi:10.1016/S2352-3018(18)30021-3.
- Orkin C et al. Doravirine/Lamivudine/Tenofovir DF continues to be Non-Inferior to Efavirenz/Emtricitabine/Teno-fovir DF in Treatment- naive Adults with HIV-1 Infection: Week 96 Results of the DRIVE-AHEAD Trial. ID Week 2018. Oral Abstract Session (LB1).
- Molina JM et al. Doravirine versus ritonavir-boosted darunavir in antiretroviral-naive adults with HIV-1(DRIVE-FORWARD): 96-week results of a randomised, double-blind, non-inferiority, phase 3 trial. Lancet HIV 2019; pii: S2352-3018(19)30336-4. doi: 10.1016/ S2352-3018(19)30336-4.
- Johnson M, Kumar P, Molina JM, et al; for the DRIVE-SHIFT Study Group. Switching to doravirine/lamivudine/tenofovir disoproxil fumarate (DOR/3TC/TDF) maintains HIV-1 virologic suppression through 48 weeks: results of the DRIVE-SHIFT trial. 2019;81(4):463-472.
- Hussain NE, Ahmed M, Managing dyslipedimia in HIV/AIDS patients: chalenges and solutions, HIV/AIDS – Research and Pallative care, 2015:7 1-10
- Data on file MSD
Utvald säkerhetstext
Pifeltro
Pifeltro® (100 mg doravirin) är en icke-nukleosid omvänd transkriptashämmare (NNRTI) i filmdragerad tablettform, antivirala medel för systemiskt bruk, Rx. Saknar subvention.
Indikationer: Pifeltro är, i kombination med andra antiretrovirala läkemedel, avsett för behandling av vuxna, och ungdomar över 12 år som väger minst 35 kg, som är infekterade med hiv‑1, utan tidigare eller nuvarande tecken på resistens mot NNRTI-läkemedel.
Kontraindikationer: Överkänslighet mot den aktiva substansen eller mot något hjälpämne. Samtidig administrering med läkemedel som är starka inducerare av enzymet cytokrom P450 CYP3A är kontraindicerat eftersom betydande minskning av plasmakoncentrationen av doravirin då förväntas, vilket kan minska effekten av Pifeltro. Dessa läkemedel är bland andra: karbamazepin, oxkarbazepin, fenobarbital, fenytoin, rifampicin, rifapentin, johannesört, mitotan, enzalutamid, lumakaftor.
Varningar och försiktighet:
NNRTI‑substitutioner och användning av doravirin: Doravirin har inte utvärderats hos patienter med tidigare virologisk svikt vid någon annan antiretroviral behandling. Det finns inte tillräckliga kliniska bevis för att stödja användningen av doravirin hos patienter med hiv‑1 med bevisad resistens mot NNRTI-läkemedel.
Samtidig användning av CYP3A‑inducerare: Samtidig förskrivning av doravirin och läkemedel som kan minska exponeringen av doravirin ska ske med försiktighet.
Immunreaktiveringssyndrom: Immunreaktiveringssyndrom har rapporterats hos patienter som behandlas med antiretroviral kombinationsbehandling. Autoimmuna sjukdomar (t.ex. Graves sjukdom, autoimmun hepatit, polymyosit och Guillain-Barrés syndrom) har också rapporterats vid immun-reaktivering. Däremot varierar tiden till debut mer och kan dröja flera månader efter behandlingsstarten.
Vanliga biverkningar: De oftast rapporterade biverkningarna som ansågs kunna ha ett möjligt eller troligt samband med doravirin var illamående (4 %) och huvudvärk (3 %). I kliniska studier var de vanligaste rapporterade biverkningarna (förekom hos (≥1/100, <1/10), patienter) onormala drömmar, sömnsvårigheter (insomnia), huvudvärk, yrsel, somnolens, illamående, diarré, gaser (flatulens), buksmärta, kräkningar, utslag, trötthet, förhöjt alaninaminotransferas.
Kliniskt signifikanta Interaktioner: Doravirin metaboliseras främst av CYP3A. Läkemedel som inducerar eller hämmar CYP3A förväntas därför påverka clearance av doravirin. Doravirin ska inte ges samtidigt som läkemedel som är starka inducerare av enzymet CYP3A eftersom betydande minskning av plasmakoncentrationen av doravirin då förväntas, vilket kan minska effekten av doravirin. Försiktighet ska iakttas vid samtidig administrering av doravirin med läkemedel som är känsliga CYP3A-substrat som också har smala terapeutiska fönster (t.ex. takrolimus och sirolimus).
Dosering: Rekommenderad dos är en 100 mg tablett peroralt en gång dagligen med eller utan föda. Om samtidig administrering med rifabutin eller andra måttliga CYP3A-inducerare (t.ex. dabrafenib, lesinurad, bosentan, tioridazin, nafcillin, modafinil, telotristatetyl) inte kan undvikas ska en 100 mg tablett Pifeltro tas två gånger dagligen (med ungefär 12 timmars mellanrum).
Särskilda patientgrupper:
Äldre: Ingen dosjustering av doravirin krävs för äldre patienter.
Nedsatt njurfunktion: Ingen dosjustering av doravirin krävs för patienter med lätt, måttligt eller gravt nedsatt njurfunktion. Doravirin har inte studerats hos patienter med terminal njursjukdom och inte heller hos patienter som genomgår dialysbehandling.
Nedsatt leverfunktion: Ingen dosjustering av doravirin krävs för patienter med lätt (Child–Pugh klass A) eller måttligt (Child–Pugh klass B) nedsatt leverfunktion. Doravirin har inte studerats hos patienter med gravt (Child–Pugh klass C) nedsatt leverfunktion. Det är okänt om exponeringen av doravirin blir högre hos patienter med gravt nedsatt leverfunktion. Försiktighet rekommenderas därför när doravirin administreras till patienter med gravt nedsatt leverfunktion.
Pediatrisk population: Säkerhet och effekt av Pifeltro hos barn under 12 år eller som väger mindre än 35 kg har inte fastställts.
Graviditet: Det finns inga eller begränsad mängd data från användningen av doravirin hos gravida kvinnor. Som en försiktighetsåtgärd bör man undvika användning av Pifeltro under graviditet.
Amning: Det är okänt om doravirin utsöndras i bröstmjölk. För att undvika överföring av hiv rekommenderas att kvinnor som lever med hiv inte ammar sina spädbarn
Datum för översyn av produktresumé: 07/2023.
För fullständiginformation, priser och förpackningar, se www.fass.se
Delstrigo
Delstrigo® (100 mg doravirin, 300 mg lamivudin och 300 mg tenofovirdisoproxilfumarat) är en antiretroviral kombinationsbehandling i filmdragerad tablettform, Rx, saknar subvention.
ATCkod: J05AR24
Indikationer: Delstrigo är avsett för behandling av vuxna som är infekterade med hiv‑1, utan tidigare eller nuvarande tecken på resistens mot NNRTI-läkemedel, lamivudin eller tenofovir.
Delstrigo är också avsett för behandling av ungdomar 12 år och äldre som väger minst 35 kg och som är infekterade med hiv‑1 utan tidigare eller i nuläget påvisad resistens mot NNRTI-läkemedel, lamivudin eller tenofovir och som har drabbats av toxicitet som utesluter användning av andra behandlingsregimer som inte innehåller tenofovirdisoproxil.
Kontraindikationer: Överkänslighet mot de aktiva substanserna eller mot något hjälpämne. Samtidig administrering med läkemedel som är starka inducerare av enzymet cytokrom P450 CYP3A är kontraindicerat. Dessa läkemedel är bland andra: karbamazepin, oxkarbazepin, fenobarbital, fenytoin, rifampicin, rifapentin, johannesört, mitotan, enzalutamid, lumakaftor.
Varningar och försiktighet:
NNRTI-substitutioner: Det finns inte tillräckliga kliniska bevis för att stödja användningen av doravirin hos patienter med hiv‑1 med bevisad resistens mot NNRTI-läkemedel.
Patienter med samtidig hiv-1 och HBV-infektion: Alla patienter med hiv‑1 ska testas avseende hepatit B-virus (HBV) innan antiretroviral behandling sätts in. Svåra akuta exacerbationer av hepatit B har rapporterats hos patienter med samtidig hiv‑1 och HBV-infektion och som avbrutit behandling med lamivudin eller tenofovirdisoproxil, två av komponenterna i Delstrigo.
Njurfunktionsnedsättning: Nedsatt njurfunktion, med fall av akut njursvikt och Fanconis syndrom (skada på njurtubuli med svår hypofosfatemi) har rapporterats vid användning av tenofovirdisoproxil, en av komponenterna i Delstrigo. Delstrigo ska undvikas om nefrotoxiska läkemedel används samtidigt eller nyligen har använts (t. ex. höga doser av eller multipla NSAID). Delstrigo ska sättas ut om beräknat CrCl understiger 50 ml/min.
Bentäthet: Användning av tenofovirdisoproxil har förknippats med en något större minskning av bentätheten och ökning av biokemiska markörer för benmetabolism. Mätningar av bentäthet ska övervägas för vuxna hiv‑1‑infekterade patienter med frakturer eller med andra riskfaktorer för osteoporos eller benförlust i anamnesen.
Mineraliseringsdefekter: Fall av osteomalaci associerat med proximal renal tubulopati, manifesterat som skelettsmärta eller smärta i extremiteterna, och som kan bidra till frakturer, har rapporterats vid behandling med tenofovirdisoproxil.
Samtidig administrering av andra antivirala produkter: Doravirin/lamivudin/ tenofovirdisoproxil ska inte administreras samtidigt med läkemedel som innehåller lamivudin, eller läkemedel som innehåller tenofovirdisoproxil, tenofoviralafenamid eller adefovirdipivoxil. Doravirin/lamivudin/tenofovirdisoproxil ska inte administreras tillsammans med doravirin såvida det inte behövs för dosjustering (t. ex. med rifabutin).
Användning med inducerare av CYP3A: Försiktighet ska iakttas vid förskrivning av doravirin med läkemedel som kan minska exponeringen av doravirin.
Immunreaktiveringssyndrom: Immunreaktiveringssyndrom har rapporterats hos patienter som behandlas med antiretroviral kombinationsbehandling. Autoimmuna sjukdomar (t.ex. Graves sjukdom, autoimmun hepatit, polymyosit och Guillain-Barrés syndrom) har också rapporterats vid immunreaktivering.
Vanliga biverkningar: De oftast rapporterade biverkningarna som ansågs kunna ha ett möjligt eller troligt samband med doravirin var illamående (4 %) och huvudvärk (3 %). I kliniska studier var de vanligaste rapporterade biverkningarna (förekom hos (≥1/100, <1/10), patienter) onormala drömmar, sömnsvårigheter (insomnia), huvudvärk, yrsel, somnolens, hosta, nasala symtom, illamående, diarré, magsmärta, kräkningar, gaser (flatulens), håravfall, utslag, muskelsjukdomar, trötthet, feber, förhöjt alaninaminotransferas.
Kliniskt signifikanta interaktioner: Delstrigo innehåller doravirin, lamivudin och tenofovirdisoproxil, därför är alla interaktioner som gäller dessa enskilda substanser relevanta för Delstrigo.
Doravirin metaboliseras främst av CYP3A och läkemedel som inducerar eller hämmar CYP3A förväntas påverka clearance av doravirin. Doravirin/ lamivudin/tenofovirdisoproxil ska inte ges samtidigt som läkemedel som är starka inducerare av enzymet CYP3A eftersom betydande minskning av plasmakoncentrationen av doravirin då förväntas, vilket kan minska effekten av doravirin/lamivudin/tenofovirdisoproxil.
Försiktighet ska iakttas vid samtidig administrering av doravirin med läkemedel som är känsliga CYP3A-substrat som också har smala terapeutiska fönster (t.ex. takrolimus och sirolimus).
Dosering: Rekommenderad dos Delstrigo är en tablett (100 mg doravirin, 300 mg lamivudin och 300 mg tenofovirdisoproxilfumarat) som tas peroralt en gång dagligen med eller utan föda. Vid samtidig administrering av måttliga CYP3A-inducerare ska en dos doravirin 100 mg administreras dagligen ungefär 12 timmar efter administrering av Delstrigo.
Särskilda patientgrupper
Äldre: Det finns begränsad mängd data om användning av doravirin, lamivudin och tenofovirdisoproxil till patienter 65 år och äldre. Det finns inga belägg för att äldre patienter skulle behöva en annan dos än yngre patienter. Särskild försiktighet rekommenderas för denna åldersgrupp på grund av åldersrelaterade förändringar som försämrad njurfunktion.
Nedsatt njurfunktion: Ingen dosjustering av Delstrigo behövs för patienter med beräknad kreatininclearance(CrCl) ≥50 ml/min. Delstrigo ska inte sättas in hos patienter med beräknad CrCl <50 ml/min. Behandling med Delstrigo ska avbrytas om beräknad CrCl sjunker under 50 ml/min.
Nedsatt leverfunktion: Ingen dosjustering av doravirin/lamivudin/tenofovirdisoproxil krävs för patienter med lätt (Child–Pugh klass A) eller måttligt (Child–Pugh klass B) nedsatt leverfunktion. Doravirin har inte studerats hos patienter med gravt nedsatt leverfunktion (Child‑Pugh klass C).
Pediatrisk population: Säkerhet och effekt av Delstrigo hos barn under 12 år eller som väger mindre än 35 kg har inte fastställts.
Graviditet: Det finns inga eller begränsad mängd data från användningen av doravirin hos gravida kvinnor. Som en försiktighetsåtgärd bör man undvika användning av Delstrigo under graviditet.
Amning: Det är okänt om doravirin utsöndras i bröstmjölk. För att undvika överföring av hiv rekommenderas att kvinnor som lever med hiv inte ammar sina spädbarn.
Datum för översyn av produktresumé: 06/2023.
För fullständig information och förpackningar, se fass.se.
