Vaxneuvance® (PCV15) hos vuxna från 18 års ålder
Vaxneuvance är ett 15-valent konjugerat pneumokockvaccin för barn och vuxna.1
Vaxneuvance innehåller 15 serotyper av Streptococcus pneumoniae 1
Vaxneuvance är avsett för aktiv immunisering för förebyggande av invasiv sjukdom och pneumoni orsakad av Streptococcus pneumoniae hos vuxna från 18 års ålder.1 Vaxneuvance ska användas i enlighet med officiella rekommendationer.
Ju fler komponenter, i det här fallet serotyper, ett vaccin innehåller desto större blir utmaningen att utveckla och tillverka vaccinet. En svårighet är att få till ett bra immunsvar per komponent.2,3
Under utvecklingen av Vaxneuvance har fokus varit ett immunsvar mot alla ingående serotyper, ett särskilt fokus har legat på serotyp 3.4,5
Serotyp 3 är en av de serotyper som orsakar flest fall av invasiv pneumokocksjukdom (IPD) i Sverige och Europa.6,7
Vaxneuvance har studerats i flera olika patientgrupper1
- Friska vuxna ≥ 50 år
- Vuxna 18–49 år med stabila underliggande medicinska tillstånd (t.ex. diabetes, njursjukdomar, kronisk hjärtsjukdom, kronisk leversjukdom, kronisk lungsjukdom inklusive astma) och/eller riskfaktorer i livsstilen (t.ex. pågående tobaksanvändning, hög alkoholkonsumtion)
- Vuxna ≥18 år med hiv
- Vuxna som genomgått hematopoetisk stamcellstransplantation
Vaxneuvance hos vuxna: Immunogenicitet vs PCV13
- Vaxneuvance framkallade immunsvar mot 15 serotyper och jämförbart med PCV13 för 13 gemensamma serotyper.1
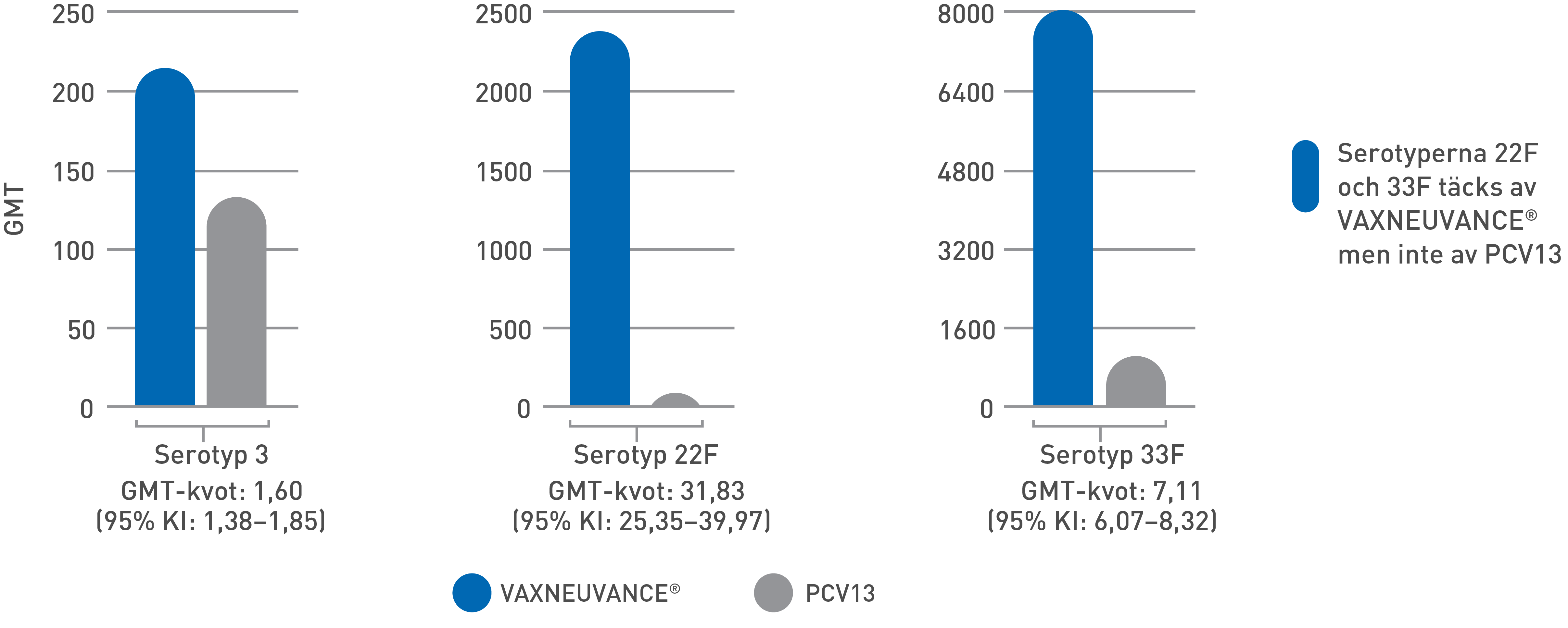
- Dessutom adderade Vaxneuvance signifikant högre immunsvar vs PCV13 mot de unika serotyperna 22F, 33F och gemensamma serotyp 3 – en av de vanligaste orsakerna till invasiv pneumokocksjukdom hos vuxna i Sverige och Europa.6,7
Serotypspecifika jämförelser av GMT för OPA1
Studiedesign: Immunogenicitet1
Pivotal, dubbelblind kontrollerad studie med aktiv komparator. 1 205 immunkompetenta studiedeltagare ≥50 år som ej tidigare vaccinerats mot pneumokocker randomiserades till att få antingen Vaxneuvance eller PCV13. Immunogeniciteten bedömdes med hjälp av serotypspecifika OPA- och IgG‑svar 30 dagar efter vaccination.
Studien syftade till att visa att GMT för OPA var jämförbara för 12 av de 13 gemensamma serotyperna; jämförbara eller högre för den gemensamma serotypen 3; och högre för serotyperna 22F och 33F som inte finns i PCV13.
Slutsats avseende non‑inferiority för de 13 gemensamma serotyperna baserades på att den nedre gränsen för 95 % KI för den beräknade GMTkvoten (Vaxneuvance/PCV13) är >0,5. Slutsats avseende signifikant högre immunogenicitet baserades på jämförelser av GMT för OPA mellan grupperna samt andelen deltagare med en ≥4‑faldig ökning av serotypspecifika OPA‑titrar 30 dagar efter vaccination jämfört med före vaccination. Slutsats avseende signifikant högre immunogenicitet för serotyp 3 baseras på att den nedre gränsen för 95 % KI för den beräknade GMT-kvoten är >1,2. Slutsats avseende signifikant högre immunogenicitet för serotyperna 22F och 33F baseras på att den nedre gränsen för 95 % KI för den beräknade GMT-kvoten är >2,0.
Dosering och administrering1
- Vuxna från 18 års ålder rekommenderas 1 dos (0,5 ml) Vaxneuvance. Vaccinet ska administreras genom intramuskulär injektion.
- Vaxneuvance kan administreras samtidigt med inaktiverat fyrvalent säsongsinfluensavaccin (QIV), förutsatt att olika nålar och injektionsställen används.
Säkerhetsprofil1
De vanligast förekommande biverkningarna för Vaxneuvance hos vuxna (n= 5 630)
| Biverkningar | Frekvens |
|---|---|
| Smärta vid injektionsstället | 64,6 % |
| Trötthet | 23,4 % |
| Myalgi | 20,7 % |
| Huvudvärk | 17,3 % |
| Svullnad vid injektionsstället | 16,1 % |
| Erytem vid injektionsstället | 11,3 % |
| Artralgi | 7,9 % |
Majoriteten av dessa biverkningar var lindriga (baserat på intensitet eller storlek) och kortvariga (≤ 3 dagar). Äldre rapporterade färre biverkningar än yngre vuxna.
Referenser
- Vaxneuvance produktresumé, 01/2025
- Schlingmann B, et al. PLoS Pathog. 2018;14(4):e1006904. Published 2018-04-05.
- Smith J, et al. Lancet. 2011;378(9789):428-438
- Platt HL, et al. Pediatr Infect Dis J. 2020;39(8):763-770
- Platt HL, et al. Vaccine. 2022;40(1):162-172
- Folkhälsomyndigheten. Pneumokockinfektion (invasiv) – sjukdomsstatistik 2023. Besökt 2024-10-26.
- European Centre for Disease Prevention and Control. Invasive pneumococcal disease. In: ECDC. Annual epidemiological report for 2018. Stockholm: ECDC. 2020.
Utvald säkerhetstext
▼ Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning.
Vaxneuvance® (konjugerat 15-valent polysackaridvaccin) är ett vaccin mot pneumokockinfektioner innehållande renade polysackaridantigener. Vaccinet innehåller 15 pneumokock-polysackaridserotyper: 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 22F, 23F, 33F. Vaxneuvance är avsett för aktiv immunisering för förebyggande av invasiv sjukdom, pneumoni och akut mellanöreinflammation orsakad av Streptococcus pneumoniae hos spädbarn, barn och ungdomar från 6 veckor till <18 års ålder. Vaxneuvance är avsett för aktiv immunisering för förebyggande av invasiv sjukdom och pneumoni orsakad av Streptococcus pneumoniae hos vuxna från 18 års ålder. Vaxneuvance ska användas i enlighet med officiella rekommendationer. Vaxneuvance injektionsvätska, suspension i förfylld spruta, Rx, ej förmån.
Kontraindikationer: Överkänslighet mot de aktiva substanserna eller mot något hjälpämne, samt mot vaccin innehållande difteritoxoid.
Varningar och försiktighet: Vaccinationen ska skjutas upp hos personer som har en akut svår febersjukdom eller akut infektion. En mindre infektion och/eller låg feber är inte skäl att skjuta upp vaccinationen.
Vaxneuvance ska administreras intramuskulärt. Ingen data finns för intradermal administrering och vaccinet får inte administreras intravaskulärt. För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer (batchnr) dokumenteras.
Administrering av Vaxneuvance under graviditet ska endast övervägas när den potentiella nyttan överväger eventuella risker för modern och fostret.
Potentiell risk för apné och behov av andningsövervakning ska beaktas vid administrering till mycket prematura spädbarn (≤28 veckor vid födseln). Vaccination bör i allmänhet inte avstås/senareläggas till denna grupp.
Personer med nedsatt immunkompetens kan få ett svagare antikroppssvar efter aktiv immunisering. Liksom med alla vaccin ger Vaxneuvance eventuellt inte fullgott skydd hos alla mottagare.
Datum för översyn av produktresumén: 01/2025
För fullständig information och förpackningar, se www.fass.se
