Vaxneuvance® (PCV15) hos barn 6 veckor till <18 år
Vaxneuvance är ett 15-valent konjugerat pneumokockvaccin för barn och vuxna.1
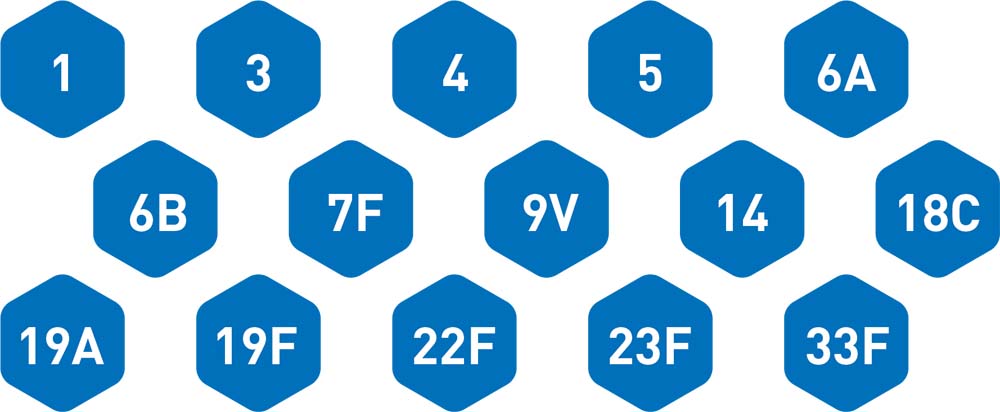
Vaxneuvance innehåller 15 serotyper av Streptococcus pneumoniae 1
Vaxneuvance är avsett för aktiv immunisering för förebyggande av invasiv sjukdom, pneumoni och akut mellanöreinflammation orsakad av Streptococcus pneumoniae hos spädbarn, barn och ungdomar från 6 veckor till <18 års ålder. 1 Vaxneuvance ska användas i enlighet med officiella rekommendationer.
Från och med 1 september 2023 ingår Vaxneuvance i barnvaccinationsprogrammet.

Vaxneuvance har studerats i flera olika pediatriska populationer
Över 7000 spädbarn och barn inkluderades i kliniska studier för att fastställa säkerheten, tolerabiliteten och immunogeniciteten hos Vaxneuvance.1
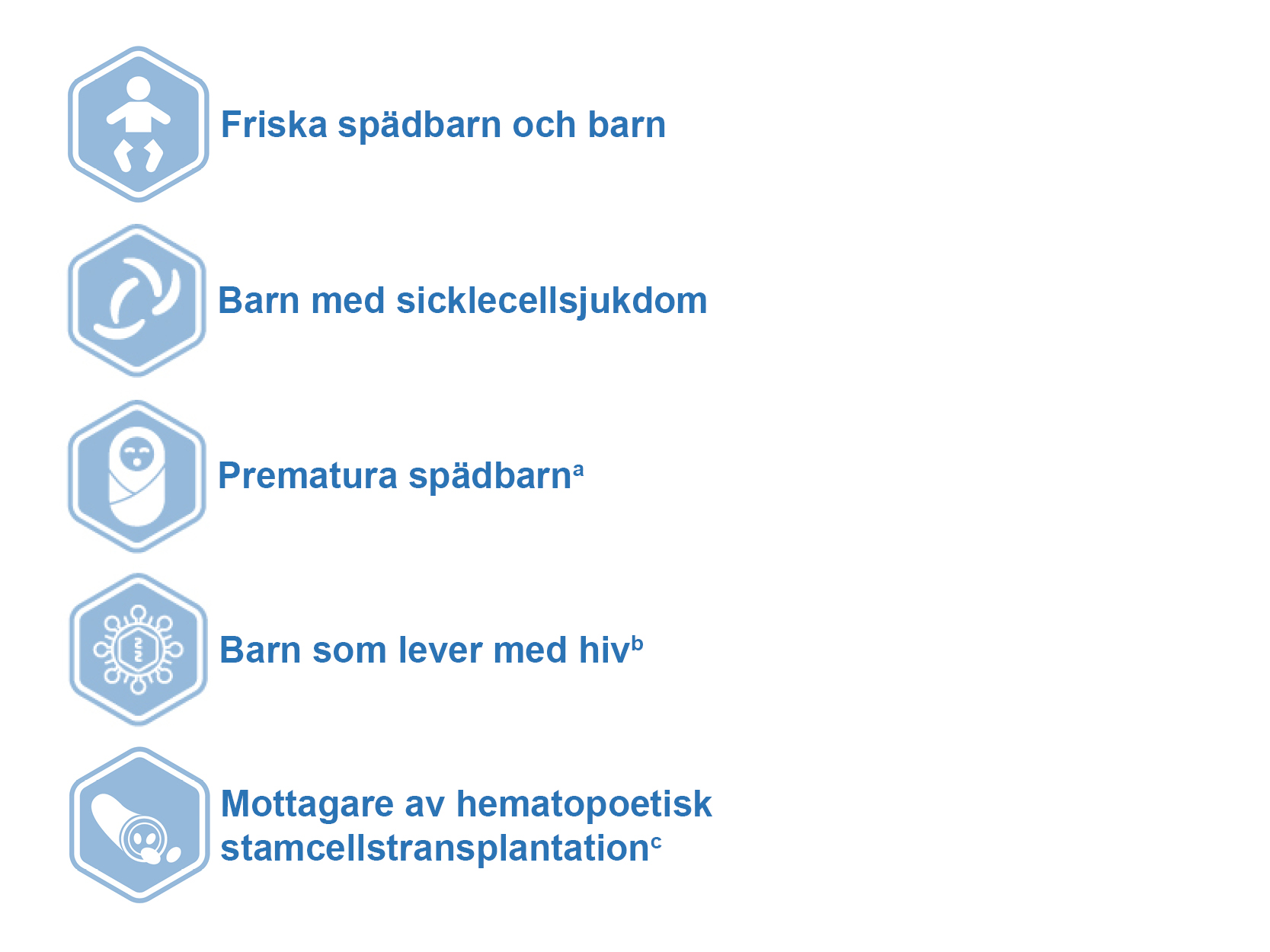
a Gestationsålder <37 veckor vid födseln.
b Denna studie inkluderade barn i åldern 6 till 17 år med CD4+ T-cellantal ≥200 celler/mikroliter och plasma hiv RNA-värde <50 000 kopior/ml.
c Denna studie genomfördes på både pediatriska (n=14) och vuxna (n=260) deltagare.
Dosering1
Immuniseringsscheman för Vaxneuvance ska baseras på officiella rekommendationer.
- Vaxneuvance kan doseras enligt schema för rutinvaccination hos spädbarn och barn i åldern 6 veckor till <2 år.
- Vaxneuvance kan doseras enligt schema för catch-up vaccination för ovaccinerade eller icke färdigvaccinerade barn mellan 7 månader och <18 års ålder.
- Spädbarn och barn som har påbörjat vaccination med ett annat konjugerat pneumokockvaccin kan gå över till Vaxneuvance när som helst under vaccinationsschemat.
Spädbarn och barn i åldern 6 veckor till <2 år
Vaxneuvance kan ges samtidigt med något av följande vaccinantigen, antingen som monovalenta eller kombinationsvacciner: difteri, tetanus, pertussis, poliomyelit (serotyper 1,2 och 3), hepatit A, hepatit B, Haemophilus influenzae typ b, mässling, påssjuka, röda hund, varicella och rotavirus.
Barn och ungdomar mellan 2 och <18 års ålder
Det finns inga data om administrering av Vaxneuvance samtidigt med andra vacciner.
Säkerhetsprofil1
Spädbarn och barn i åldern 6 veckor till <2 år
Säkerheten för Vaxneuvance hos friska spädbarn, inklusive prematura spädbarn (från 6 veckor gamla vid första vaccinationen) och barn (11 till och med 15 månader gamla) bedömdes för en dosregim med 3 eller 4 doser i 5 kliniska studier med totalt 7 229 studiedeltagare. Alla 5 studierna utvärderade säkerheten av Vaxneuvance vid samtidig administrering av andra pediatriska vacciner som ges rutinmässigt.
De vanligast förekommande biverkningarna för Vaxneuvance hos barn
Spädbarn och barn
i åldern 6 veckor till <2 år (n= 4 824)
| Biverkningar | Frekvens |
|---|---|
| Feber ≥38 °C | 75,2 % |
| Irritabilitet | 74,5 % |
| Somnolens | 55,0 % |
| Smärta vid injektionsstället | 44,4 % |
| Erytem vid injektionsstället | 41,7 % |
| Minskad aptit | 38,2 % |
| Förhårdnad vid injektionsstället | 28,3 % |
| Svullnad vid injektionsstället | 28,2 % |
Barn och ungdomar
mellan 2 och <18 års ålder (n= 352)
| Biverkningar | Frekvens |
|---|---|
| Smärta vid injektionsstället | 54,8 % |
| Myalgi | 23,7 % |
| Svullnad vid injektionsstället | 20,9 % |
| Erytem vid injektionsstället | 19,2 % |
| Trötthet | 15,8 % |
| Huvudvärk | 11,9 % |
| Förhårdnad vid injektionsstället | 6,8 % |
| Feber ≥38 °C | 5,6 % |
Majoriteten av de biverkningar som efterfrågades var milda till måttliga (baserat på intensitet eller omfattning) och kortvariga (≤3 dagar).
Referenser
- Vaxneuvance produktresumé, 01/2025
Utvald säkerhetstext
▼ Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning.
Vaxneuvance® (konjugerat 15-valent polysackaridvaccin) är ett vaccin mot pneumokockinfektioner innehållande renade polysackaridantigener. Vaccinet innehåller 15 pneumokock-polysackaridserotyper: 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 22F, 23F, 33F. Vaxneuvance är avsett för aktiv immunisering för förebyggande av invasiv sjukdom, pneumoni och akut mellanöreinflammation orsakad av Streptococcus pneumoniae hos spädbarn, barn och ungdomar från 6 veckor till <18 års ålder. Vaxneuvance är avsett för aktiv immunisering för förebyggande av invasiv sjukdom och pneumoni orsakad av Streptococcus pneumoniae hos vuxna från 18 års ålder. Vaxneuvance ska användas i enlighet med officiella rekommendationer. Vaxneuvance injektionsvätska, suspension i förfylld spruta, Rx, ej förmån.
Kontraindikationer: Överkänslighet mot de aktiva substanserna eller mot något hjälpämne, samt mot vaccin innehållande difteritoxoid.
Varningar och försiktighet: Vaccinationen ska skjutas upp hos personer som har en akut svår febersjukdom eller akut infektion. En mindre infektion och/eller låg feber är inte skäl att skjuta upp vaccinationen.
Vaxneuvance ska administreras intramuskulärt. Ingen data finns för intradermal administrering och vaccinet får inte administreras intravaskulärt. För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer (batchnr) dokumenteras.
Administrering av Vaxneuvance under graviditet ska endast övervägas när den potentiella nyttan överväger eventuella risker för modern och fostret.
Potentiell risk för apné och behov av andningsövervakning ska beaktas vid administrering till mycket prematura spädbarn (≤28 veckor vid födseln). Vaccination bör i allmänhet inte avstås/senareläggas till denna grupp.
Personer med nedsatt immunkompetens kan få ett svagare antikroppssvar efter aktiv immunisering. Liksom med alla vaccin ger Vaxneuvance eventuellt inte fullgott skydd hos alla mottagare.
Datum för översyn av produktresumén: 01/2025
För fullständig information och förpackningar, se www.fass.se
