WINREVAIR (sotatercept)
Pulmonell arteriell hypertension (PAH)
WINREVAIR är en aktivinsignalhämmare som i kombination med andra behandlingar för PAH är indicerat för behandling av PAH hos vuxna patienter med WHO-funktionsklass (FC) II till III, för att förbättra fysisk arbetsförmåga.1 Winrevair administreras en gång var 3:e vecka som subkutan engångsinjektion i enlighet med patientens vikt.1
WINREVAIR är den första och enda aktivinsignalhämmaren och verkningsmekanismen ger en helt ny behandlingsmöjlighet för människor med PAH.1,2
WINREVAIR är en aktivinsignalhämmare med hög selektivitet för aktivin-A, ett dimeriskt
glykoprotein som tillhör den transformerande tillväxtfaktor-β-(TGF-β)-superfamiljen av ligander.
Aktivin-A binder till aktivinreceptor typ IIA (ActRIIA) som reglerar viktig signalering för inflammation, cellproliferation, apoptos och vävnadshomeostas.1,2
Nivåerna av aktivin-A är förhöjda hos PAH-patienter.
Bindning av aktivin till ActRIIA främjar proliferativ signalering samtidigt som den antiproliferativa signaleringen via benmorfogenesproteinreceptor typ II (BMPRII) minskar. Obalansen i ActRIIA-BMPRII-signalering vid PAH resulterar i hyperproliferation av kärlväggens celler, vilket orsakar patologisk remodellering av lungartärväggen, förträngning av artärlumen, ökat pulmonellt vaskulärt motstånd och leder till ökat pulmonellt artärtryck och högerkammardysfunktion.1,2
WINREVAIR består av ett rekombinant homodimert fusionsprotein av aktivinreceptor typ IIA-Fc (ActRIIA-Fc) som fungerar som en ligandfälla som avlägsnar överskott av aktivin-A och andra ligander för ActRIIA för att hämma aktivinsignalering. Därigenom återbalanserar sotatercept den proliferativa (ActRIIA/Smad2/3-medierade) och anti-proliferativa (BMPRII/Smad1/5/8-medierade) signaleringen för att modulera vaskulär proliferation. 1,2
I modeller av PAH minskade en sotaterceptanalog uttrycket av proinflammatoriska markörer vid lungartärväggen, minskade leukocytrekryteringen, hämmade proliferationen av endotelceller och glatta muskelceller och främjade apoptos i sjuka kärl. Dessa cellförändringar var associerade med tunnare kärlväggar, omvänd artär- och högerkammarremodellering och förbättrad hemodynamik.1
Den pivotala studien for WINREVAIR i denna indikation är STELLAR, en dubbelblind, placebokontrollerad, klinisk multicenterstudie med parallella grupper. 323 patienter med PAH (WHO-grupp 1, funktionsklass II eller III) randomiserades 1:1 till sotatercept (startdos 0,3 mg/kg upptrappad till måldos 0,7 mg/kg) (n=163) eller placebo (n=160) administrerat subkutant en gång var 3:e vecka. Patienter fortsatte sin behandling i den dubbelblindade behandlingsperioden över lång tid tills alla patienter hade slutfört vecka 24.1,3
De flesta deltagarna fick bakgrundsbehandling med standardbehandling för PAH, antingen trippel (61,3 %) eller dubbel (34,7 %) behandling, och mer än en tredjedel (39,9 %) fick prostacyklininfusioner. 1,3
Primärt effektmått
Det primära effektmåttet var förändringen av 6-minuters gångavstånd (6MWD) från baslinjen till vecka 24. I gruppen som fick behandling med WINREVAIR var medianvärdet för den placebojusterade förändringen av 6MWD 40,8 meter (95 % KI: 27,5; 54,1, p < 0,001) från baslinjen till vecka 24. Behandlingseffekten observerades också i undergrupper. 1,3
Behandlingseffekten var överensstämmande mellan de olika undergrupperna inklusive kön, diagnosgrupp för PAH, bakgrundsterapi vid baslinjen, infusionsbehandling med prostacyklin vid baslinjen, WHO FC och PVR vid baslinjen.1,3
Median Change from Baseline at Week 24 in 6MWD (meters) at week 24 in the ITT population*3
Adapted from figure S4 in the supplement to Hoeper M.M, Badesch DB, Ghofrani HA, et al.
The forest plot shows the effects of sotatercept compared with placebo on median change from baseline in 6-minute walk distance (meters) at week 24 in pre-defined patient subgroups as specified per study protocol. The graph plots the Hodges-Lehmann location shift point estimates for between-group differences in the average imputed median values (95% CI) for each subgroup.
Hodges-Lehmann location shift from placebo estimate (median of the placebo-adjusted change from baseline at week 24).3
Change from baseline in 6MWD at week 24 for subjects who died was assigned a value of -2000 meters to receive the worst rank.3
Change from baseline in 6MWD at week 24 for subjects who have missing data due to a non-fatal clinical worsening event was imputed to -1000 meters to receive the next-worst rank.3
Subgroup analyses are not powered to demonstrate a statistically significant difference. Small patient numbers and lack of multiplicity adjustments for some subgroups can be a limitation of these analyses. Therefore, no conclusions can be drawn from these data.2
Sekundära effektmått
De sekundära effektmåtten inkluderade förbättringar av flera effektmått (multicomponent improvement, MCI), PVR, N-terminal pro-B-typ natriuretisk peptid (NT-proBNP), WHO FC, tid till död eller första förekomsten av händelse med klinisk försämring.1,3
MCI var ett fördefinierat effektmått mätt som andelen patienter som uppnådde alla tre av följande kriterier vecka 24 i förhållande till baslinjen:1,3
- förbättring av 6MWD (ökning ≥ 30 m)1,3
- förbättring av NT-proBNP(minskning av NT-proBNP ≥ 30 % eller upprätthållande/uppnående av NT-proBNP-nivå < 300 ng/l). 1,3
- förbättring av WHO FC eller bibehållande av WHO FC II. 1,3
Kombinationsbehandling med WINREVAIR standardbehandling förbättrade signifikant MCI jämfört med placebogruppen med standardbehandling. 1,3
Patients taking WINREVAIR experienced significant multicomponent improvement (MCI) vs placebo1,3
Adapted from table 2 in Hoeper MM, Badesch DB, Ghofrani HA, et al; STELLAR Trial Investigators. Phase 3 trial of sotatercept for treatment of pulmonary arterial hypertension. N Engl J Med. 2023;388(16):1478-1490.
a A missing result at week 24 not due to COVID-19 was considered a nonresponder. Subjects who missed assessments due to COVID-19 were removed from the denominator.
b Comparison with placebo uses Cochran-Mantel-Haenszel method stratified by randomization factors.
Kombinationsbehandling med WINREVAIR + standardbehandling förbättrade signifikant pulmonary vascular resistance (PVR) samt N-terminal pro-B-type natriuretic peptide (NT-proBNP) jämfört med placebogruppen med standardbehandling.1,3
Change from the baseline at week 24
Adapted from table 2 i Hoeper MM, Badesch DB, Ghofrani HA, et al; N Engl J Med. 2023;388(16):1478-1490
a Hodges-Lehmann location shift from placebo estimate (median of the placebo-adjusted change from baseline at week 24).
b Change from baseline in PVR at week 24 for subjects who died was assigned as 20000 to receive the worst rank. Change from baseline in PVR at week 24 for subjects who had missing data due to a non-fatal clinical worsening event was imputed as 15000 to receive the next-worst rank.
c Change from baseline in NT-proBNP at week 24 for subjects who died was assigned as 200000 to receive the worst rank. Change from baseline in NT-proBNP at week 24 for subjects who had missing data due to a non-fatal clinical worsening event was imputed as 150000 to receive the next-worst rank.
d There were 3 placebo participants with no NT-proBNP samples at any timepoint. In such cases, missing data were not imputed.
e Wilcoxon p-value refers to p-value from the aligned rank-stratified Wilcoxon test with randomization factors as strata.
Signifikant fler patienter i WINREVAIR+ standardbehandling gruppen förbättrade sin WHO FC från baslinjen jämfört med patienter med placebo + standardbehandling.1,3
Significantly more patients taking WINREVAIR improved their World Health Organization (WHO) functional class (FC) vs placebo
Adapted from table 2 in Hoeper MM, Badesch DB, Ghofrani HA, et al; STELLAR Trial Investigators. Phase 3 trial of sotatercept for treatment of pulmonary arterial hypertension. N Engl J Med. 2023;388(16):1478-1490.
a A missing result at week 24 not due to COVID-19 was considered a nonresponder. Subjects who missed assessments due to COVID-19 were removed from the denominator.
b Comparison with placebo uses Cochran-Mantel-Haenszel method stratified by randomization factors.
Behandling med WINREVAIR + standardbehandling resulterade i en 82 % minskning (HR 0,182, 95 % KI: 0,075; 0,441, p < 0,001) i dödsfall eller händelse med klinisk försämring jämfört med placebo.1,3 Behandlingseffekten av WINREVAIR jämfört med placebo startade vecka 10 och fortsatte under hela studien.1
WINREVAIR significantly reduced the occurrence of death or clinical worsening events vs placebo
~82%
Relative reduction in risk of death or a clinical worsening eventa
(HR 0.182, 95% CI: 0.075, 0.44; p<0.001)b,c
Seven of 163 (4.3%) patients in the WINREVAIR group experienced death or at least one clinical worsening event, compared with 29 of 160 (18,1%) patients in the placebo group.
Clinical worsening events and death were captured until the last patient completed the week 24 visit (data up to the data cutoff). The median duration of exposure was 33.6 weeks.
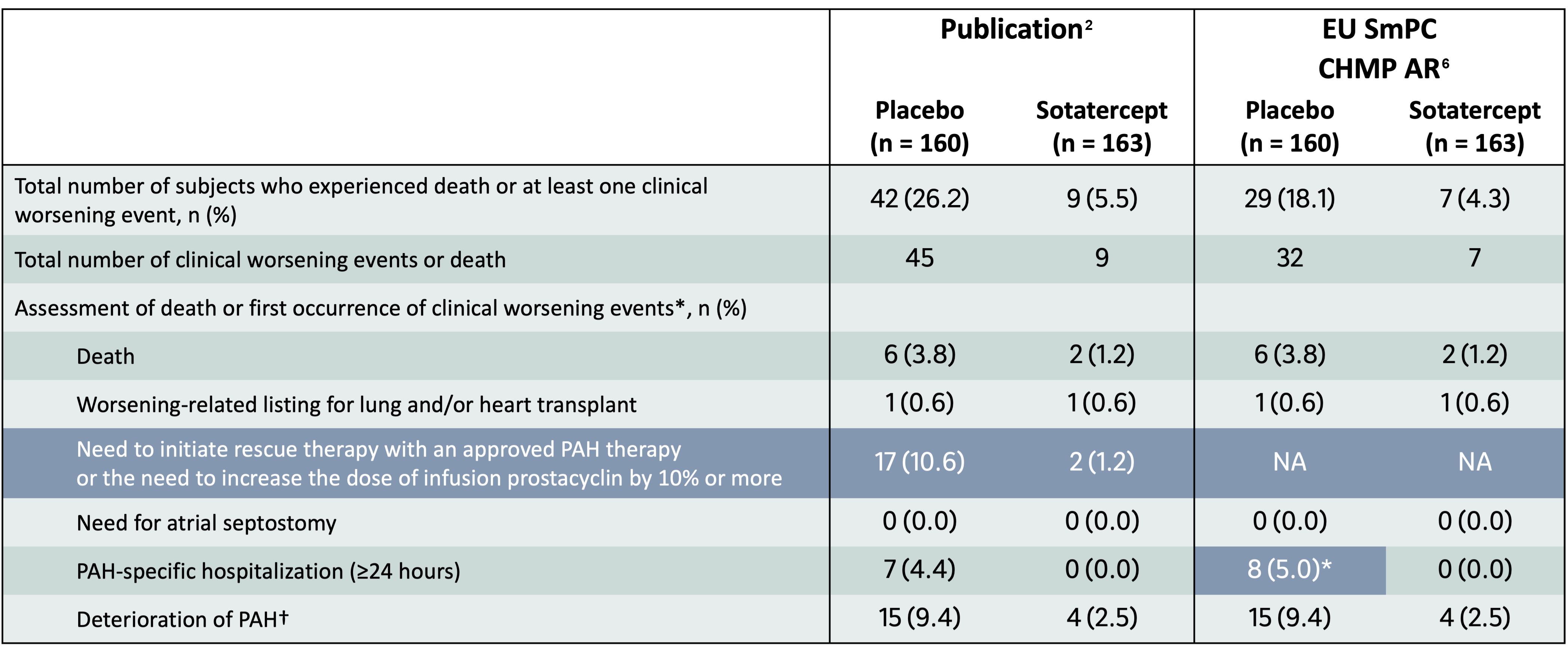
*This analysis counts 8 participants in the placebo group with a first clinical worsening event of “PAH-specific hospitalization (>24 hours)”, whereas the primary analysis counts 7. The explanation for this difference is that a placebo participant had a first clinical worsening event of “need to initiate rescue therapy with an approved PAH therapy or need to increase the dose of infusion prostacyclin by 10% or more” and a subsequent event of “PAH-specific hospitalization (>24 hours).” The primary analysis counted this participant according to the first event. Because the endpoint for the analysis in does not include “need to initiate rescue therapy with an approved PAH therapy or need to increase the dose of infusion prostacyclin by 10% or more”, the first nonfatal clinical worsening event “PAH-specific hospitalization (>24 hours)” was counted for this placebo participant.
Biverkningar
Säkerheten för WINREVAIR utvärderades i STELLAR studien.
Mediandurationen för behandling med WINREVAIR var 313 dagar.1,3
- De vanligaste rapporterade biverkningarna var huvudvärk (24,5 %), epistaxis (22,1 %), telangiektasi (16,6 %), diarré (15,3 %), yrsel (14,7 %), utslag (12,3 %) och trombocytopeni (10,4 %).
- De vanligaste rapporterade allvarliga biverkningarna var trombocytopeni (< 1 %) och epistaxis (< 1 %).
- De vanligaste biverkningarna som orsakade avbruten behandling var epistaxis och telangiektasi.
För mer information om biverkningar se www.fass.se
Dosering
Winrevair administreras en gång var 3:e vecka som subkutan engångsinjektion i enlighet med patientens vikt. Hemoglobinvärde (Hb) och trombocytantal ska kontrolleras före den första dosen. Initiering av behandling är kontraindicerat om trombocytantalet är konsekvent < 50 x 109/l. Behandlingen initieras med en engångsstartdos på 0,3 mg/kg.1 Se tabell.
Tre veckor efter en engångsstartdos på 0,3 mg/kg ska dosen trappas upp till den rekommenderade måldosen på 0,7 mg/kg efter att acceptabelt Hb och trombocytantal bekräftats.
Behandlingen ska fortsätta med 0,7 mg/kg var 3:e vecka såvida inte dosjusteringar krävs.1
Vill du läsa hela STELLAR-publikationen?
Använd följande länk:
Referenser
- WINREVAIR produktresumé, fass.se.
- Humbert M, McLaughlin V, Gibbs SR, et al; Sotatercept for the treatment of pulmonary arterial hypertension. N Engl J Med. 2021; 384:1204–1215.
- Hoeper MM, Badesch DB, Ghofrani HA, et al; STELLAR Trial Investigators. Phase 3 trial of sotatercept for treatment of pulmonary arterial hypertension. N Engl J Med. 2023;388(16) (suppl): S1-S69.
▼Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning.
Winrevair (sotatercept) 45 mg och 60 mg pulver och vätska till injektionsvätska, lösning. Antihypertensiva medel för pulmonell arteriell hypertension, C02KX06, Rx, Subventioneras ej. Terapeutisk indikation: Winrevair är, i kombination med andra behandlingar för pulmonell arteriell hypertension (PAH), indicerat för behandling av PAH hos vuxna patienter med WHO-funktionsklass (FC) II till III, för att förbättra fysisk arbetsförmåga.
Kontraindikationer: Överkänslighet mot den aktiva substansen eller mot något hjälpämne. Patienter med trombocytantal konsekvent < 50 x 109/l innan initiering av behandling.
Dosering och administreringssätt: Behandling ska endast initieras och övervakas av läkare med erfarenhet av diagnostisering och behandling av PAH. Administreras en gång var 3:e vecka som subkutan engångsinjektion i enlighet med patientens vikt. Hemoglobinvärde (Hb) och trombocytantal ska kontrolleras före den första dosen. Behandlingen initieras med en engångsstartdos på 0,3 mg/kg. Tre veckor efter startdosen ska dosen trappas upp till den rekommenderade måldosen på 0,7 mg/kg efter att acceptabelt Hb och trombocytantal bekräftats. Behandlingen ska fortsätta med 0,7 mg/kg var 3:e vecka såvida inte dosjusteringar krävs. Hb och trombocytantal ska övervakas för de första 5 doserna eller längre om värdena är instabila. Därefter ska Hb och trombocytantal bekräftas var 3:e till var 6:e månad och dosen justeras om nödvändigt. Om något av följande inträffar ska behandlingen skjutas upp i 3 veckor: Hb ökar > 1,24 mmol/l (2 g/dl) från föregående dos och ligger över den övre normalgränsen (ULN), Hb ökar > 2,48 mmol/l (4 g/dl) från baslinjen, Hb ökar > 1,24 mmol/l (2 g/dl) över ULN, trombocytantalet minskar till < 50 x 109/l. Hb och trombocytantal ska kontrolleras igen innan behandlingen återupptas. Om behandlingen har skjutits upp > 9 veckor ska behandlingen återupptas med 0,3 mg/kg och dosen ska trappas upp till 0,7 mg/kg efter att acceptabelt Hb och trombocytantal har bekräftats. För behandlingar som skjutits upp > 9 veckor på grund av trombocytantal konsekvent < 50 x 109/l ska läkaren göra en nytta/risk-omvärdering för patienten innan behandlingen återupptas. Ingen dosjustering krävs för äldre patienter ≥ 65 år, vid nedsatt njurfunktion eller nedsatt leverfunktion. Ska beredas före användning och administreras som subkutan injektion. Winrevair pulver och vätska till injektionsvätska, lösning är avsett att användas under ledning och uppsikt av sjukvårdspersonal. Patienter och vårdare kan administrera läkemedlet när det anses lämpligt och när de utbildats av sjukvårdspersonal.
Varningar och försiktighet: För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras. Förhöjt Hb har observerats under behandling. Allvarlig erytrocytos kan öka risken för tromboemboliska händelser och hyperviskositetssyndrom. Använd försiktighet hos patienter med erytrocytos som har ökad risk för tromboemboliska händelser. Minskat antal trombocyter har observerats hos vissa patienter som tar sotatercept inklusive allvarlig trombocytopeni (trombocytantal < 50 x 109/l). Allvarlig trombocytopeni kan öka risken för blödningshändelser. Allvarliga blödningshändelser har observerats i kliniska studier. Patienter ska informeras om tecken och symtom på blodförlust. En läkare ska utvärdera och behandla blödningshändelser. Sotatercept ska inte administreras om patienten har en allvarlig blödningshändelse.
Hjälpämnen: Innehåller polysorbat som kan orsaka allergiska reaktioner.
Interaktioner: Inga interaktionsstudier har utförts.
Biverkningar: De vanligaste rapporterade biverkningarna var huvudvärk, epistaxis, telangiektasi, diarré, yrsel, utslag, trombocytopeni och förhöjt hemoglobin.
Graviditet och amning: Graviditetstest rekommenderas för fertila kvinnor innan behandling påbörjas. Fertila kvinnor ska använda effektivt preventivmedel under behandling och i minst 4 månader efter den sista dosen. Winrevair rekommenderas inte under graviditet eller till fertila kvinnor som inte använder preventivmedel. Amning ska avbrytas under behandling och under 4 månader efter den sista behandlingsdosen.
Datum för översyn av produktresumé 03/2025
För fullständig information, priser och förpackningar, se www.fass.se.
MSD Sverige AB, Box 45 192 Stockholm, Telefon 08-678 135 00, msd.se
SE-SOT-00007 04/2025
