KEYTRUDA (pembrolizumab)
KEYTRUDA (pembrolizumab)
Den 17 juli år 2015 godkändes KEYTRUDA (pembrolizumab) av EMA – Europeiska läkemedelsmyndigheten – för behandling av cancersjukdom1.
Den första godkända indikationen var KEYTRUDA som monoterapi för behandling av avancerat inoperabelt eller metastaserat melanom bland vuxna. Sedan dess har över 30 indikationer godkänts inom 14 tumörområden.2
Verkningsmekanismen för KEYTRUDA2
KEYTRUDA är en humaniserad monoklonal antikropp som binder till programmerad celldöd‑1 (PD‑1)‑receptorn.
Immunterapi är ett av flera angreppssätt att behandla cancersjukdomar.
När immunförsvaret fungerar som det ska, aktiveras T-celler och kan attackera tumörceller.3
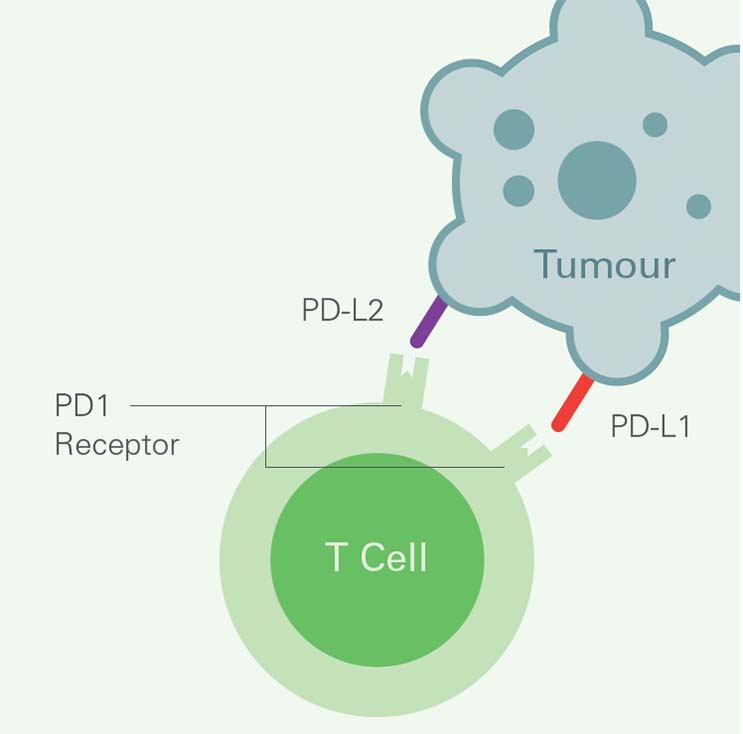
En del tumörer kan dock kringgå immunförsvaret genom signaleringsvägen programmerad celldöd (PD). På dessa tumörcellers yta återfinns ligander, PD-L1 respektive PD-L2 vilka binder till PD-1-receptorer på T-celler. Genom denna mekanism inaktiveras T-cellernas antitumorala förmåga, och tumörcellerna kan undgå immunförsvaret.3
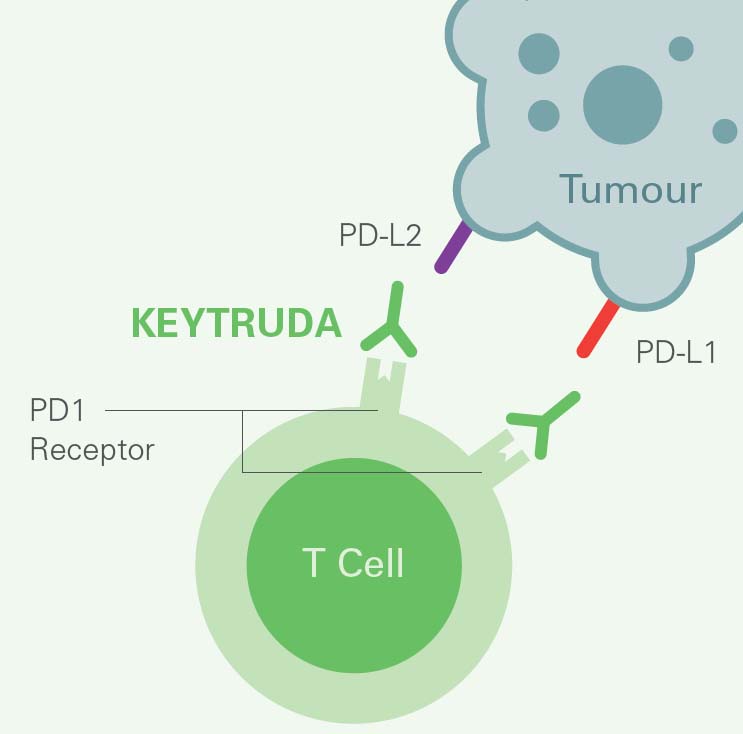
Verkningsmekanismen bakom KEYTRUDA, en monoklonal antikropp, sker genom att PD-1-receptorer på T-cellerna blockeras så att varken PD-L1 eller PD-L2 kan binda in. Då möjliggörs en reaktivering av de tumörspecifika cytotoxiska T-cellerna i tumörens mikromiljö och immunförsvaret återfår sin antitumorala förmåga.2,3
Två doseringalternativ med KEYTRUDA®:


* 52 veckor / 6 = 8,66 eller 52 veckor / 3 = 17,33
Infusionstiden för båda doseringsalternativen är 30 minuter.
Dessa doseringsalternativ gäller vuxna,
för pediatriska patienter med cHL och melanom, se fass.se
KEYTRUDA är godkänt för behandling inom dessa tumörområden
TIDIGT STADIUM
Neoadjuvant KEYTRUDA + kemoterapi / Adjuvant KEYTRUDA
KEYNOTE‑522
Matstrupe
Magsäck inkl gastroesofageala övergången (GEJ)
METASTASERAT STADIUM
1L KEYTRUDA + kemoterapi, HER2+, PD–L1 CPS >1
KEYNOTE‑811
METASTASERAT STADIUM
1L KEYTRUDA + kemoterapi HER2-, PD–L1 CPS >1
KEYNOTE‑859
Endast magsäck
Gallvägar
Kolorektal
Tunntarm
Livmoderkropp
Livmoderhals
METASTASERAT STADIUM
1L/2L KEYTRUDA + kemoterapi +/- bevacizumab
KEYNOTE‑826
TIDIGT STADIUM
Neoadjuvant KEYTRUDA + kemoterapi / Adjuvant KEYTRUDA
KEYNOTE‑671
Njure
Urinblåsa
Vill du komma i kontakt med oss som arbetar med KEYTRUDA?
Referenser
- https://www.ema.europa.eu/en/medicines/human/EPAR/keytruda
- KEYTRUDA® (pembrolizumab), SPC fass.se
-
Harvey, RD. Immunologic and Clinical Effects of Targeting PD-1 in Lung Cancer. Clin Pharm
Therapeutics. 2014:96 (2):214–23. doi:10.1038 /clpt 2014.74

Utvald säkerhetstext
KEYTRUDA® (pembrolizumab), Antineoplastiska medel, PD-1/PDL-1-hämmare, L01FF02, Rx, Subventioneras ej, SPC 11/2025
Indikationer:
Melanom
- KEYTRUDA som monoterapi är indicerat för adjuvant behandling av vuxna och ungdomar från 12 års ålder med melanom i stadium IIB, IIC eller III efter total resektion.
- KEYTRUDA som monoterapi är indicerat för behandling av vuxna och ungdomar från 12 års ålder med avancerat (inoperabelt eller metastaserat) melanom.
Icke-småcellig lungcancer (NSCLC)
KEYTRUDA i kombination med platinabaserad kemoterapi som neoadjuvant behandling, och därefter fortsatt som monoterapi för adjuvant behandling, är indicerat för behandling av resektabel icke småcellig lungcancer hos vuxna med hög risk för recidiv.
KEYTRUDA som monoterapi är indicerat för behandling av vuxna patienter med:
- adjuvant behandling av NSCLC med hög risk för recidiv efter total resektion och platinabaserad kemoterapi.
- metastaserad NSCLC i första linjen vars tumörer uttrycker PD-L1 i ≥ 50 % av tumörcellerna (tumor proportion score (TPS) ≥ 50 %) och som inte är positiva för mutationer i EGFR eller ALK.
- lokalt avancerad eller metastaserad NSCLC vars tumörer uttrycker PD L1 i ≥ 1 % av tumörcellerna (TPS ≥ 1 %) och som tidigare behandlats med åtminstone en kemoterapiregim. Patienter vars tumörer är positiva för mutationer i EGFR eller ALK ska även ha erhållit målstyrd behandling innan de behandlas med KEYTRUDA.
KEYTRUDA som kombinationsbehandling är indicerat för vuxna patienter med:
- metastaserad NSCLC av icke-skivepiteltyp vars tumörer inte är positiva för mutationer i EGFR eller ALK i första linjen i kombination med platinabaserad kemoterapi och pemetrexed.
- metastaserad NSCLC av skivepiteltyp i första linjen i kombination med karboplatin och antingen paklitaxel eller nab-paklitaxel.
Malignt pleuramesoteliom (MPM)
- KEYTRUDA i kombination med pemetrexed och platinabaserad kemoterapi är indicerat som första linjens behandling hos vuxna med inoperabelt icke-epitelialt malignt pleuramesoteliom.
Klassiskt Hodgkins lymfom (cHL)
- KEYTRUDA som monoterapi är indicerat för behandling av vuxna och barn från 3 år med recidiverande eller refraktär klassiskt Hodgkins lymfom (cHL) som inte svarat på autolog stamcellstransplantation (ASCT) eller efterföljande minst två tidigare behandlingar då ASCT inte är ett behandlingsalternativ.
Urotelial cancer (UC)
- KEYTRUDA i kombination med enfortumab vedotin är indicerat som första linjens behandling av inoperabel eller metastaserad urotelial cancer hos vuxna.
- KEYTRUDA som monoterapi är indicerat för behandling av lokalt avancerad eller metastaserad urotelial cancer (UC) hos vuxna: som tidigare behandlats med platinabaserad kemoterapi, eller som inte är lämpade för cisplatinbaserad kemoterapi och vars tumörer uttrycker PD-L1 ≥ 10 enligt metoden combined positive score (CPS).
Skivepitelcancer i huvud och hals (HNSCC)
- KEYTRUDA som monoterapi är indicerat för behandling av resektabel lokalt avancerad skivepitelcancer i huvud och hals som neoadjuvant behandling, fortsatt som adjuvant behandling i kombination med strålbehandling med eller utan konkomitant cisplatin och därefter som monoterapi hos vuxna vars tumörer uttrycker PD L1 ≥ 1 enligt metoden CPS.
- KEYTRUDA som monoterapi är indicerat för behandling av recidiverande eller metastaserad HNSCC hos vuxna vars tumörer uttrycker PD-L1 i ≥ 50 % av tumörcellerna (TPS ≥ 50 %) och progression under pågående eller efter avslutad platinabaserad kemoterapi.
- KEYTRUDA som monoterapi eller i kombination med platinabaserad kemoterapi och 5-flurorouracil (5-FU) är indicerat som första linjens behandling av metastaserad eller recidiverande inoperabel HNSCC hos vuxna vars tumörer uttrycker PD-L1 ≥ 1 enligt metoden CPS.
Njurcellscancer (RCC)
- KEYTRUDA som monoterapi är indicerat för adjuvant behandling av vuxna med RCC vid ökad risk för recidiv efter nefrektomi eller efter nefrektomi och resektion av metastaserade lesioner.
- KEYTRUDA i kombination med axitinib eller lenvatinib är indicerat som första linjens behandling av avancerad RCC hos vuxna.
Cancer som uppvisar hög mikrosatellitinstabilitet (MSI-H) eller defekt mismatch repair (dMMR)
Kolorektalcancer (CRC)
KEYTRUDA som monoterapi är indicerat för vuxna med CRC som uppvisar MSI-H eller dMMR i följande behandlingslinjer:
- första linjens behandling av metastaserad CRC.
- behandling av inoperabel eller metastaserad CRC efter tidigare fluoropyrimidinbaserad kombinationsbehandling.
Icke-kolorektal cancer
KEYTRUDA som monoterapi är indicerat för behandling av följande tumörer som uppvisar MSI-H eller dMMR hos vuxna med:
- avancerad eller recidiverande endometriecancer med sjukdomsprogression under eller efter tidigare platinabaserad behandling oavsett behandlingslinje, och som inte är kandidater för kurativ kirurgi eller strålning.
- inoperabel eller metastaserad ventrikel-, tunntarms- eller gallvägscancer med sjukdomsprogression under eller efter åtminstone en tidigare behandling.
Esofaguscancer
- KEYTRUDA i kombination med platinabaserad kemoterapi och fluoropyrimidin är indicerat som första linjens behandling av lokalt avancerad inoperabel eller metastaserad esofaguscancer hos vuxna vars tumörer uttrycker PD-L1 ≥ 10 enligt metoden CPS.
Trippelnegativ bröstcancer (TNBC)
- KEYTRUDA i kombination med kemoterapi som neoadjuvant behandling, och därefter fortsatt som monoterapi för adjuvant behandling efter kirurgi, är indicerat för behandling av lokalt avancerad eller tidigt stadie av trippelnegativ bröstcancer hos vuxna med hög risk för recidiv.
- KEYTRUDA i kombination med kemoterapi är indicerat för behandling av lokalt recidiverande inoperabel eller metastaserad TNBC hos vuxna vars tumörer uttrycker PD-L1 ≥ 10 enligt metoden CPS och som inte tidigare behandlats med kemoterapi för metastaserad sjukdom.
Endometriecancer (EC)
- KEYTRUDA i kombination med karboplatin och paklitaxel är indicerat som första linjens behandling av primärt avancerad eller recidiverande endometriecancer hos vuxna för vilka systemisk behandling är lämplig.
- KEYTRUDA i kombination med lenvatinib är indicerat för behandling av avancerad eller recidiverande endometriecancer (EC) hos vuxna med sjukdomsprogression under eller efter tidigare platinabaserad behandling, oavsett behandlingslinje, och som inte är kandidater för kurativ kirurgi eller strålning.
Cervixcancer
- KEYTRUDA i kombination med radiokemoterapi (extern strålbehandling följt av brachyterapi) är indicerat för behandling av lokalt avancerad cervixcancer hos vuxna i stadium III-IVA enligt FIGO 2014 som inte fått definitiv behandling tidigare.
- KEYTRUDA i kombination med kemoterapi med eller utan bevacizumab är indicerat för behandling av kvarvarande, recidiverande eller metastaserad cervixcancer hos vuxna vars tumörer uttrycker PD-L1 ≥ 1 enligt metoden CPS.
Adenokarcinom i ventrikel eller gastroesofageala övergången
- KEYTRUDA i kombination med trastuzumab, fluoropyrimidin och platinabaserad kemoterapi är indicerat som första linjens behandling av lokalt avancerad inoperabel eller metastaserad HER2-positiv adenokarcinom i ventrikel eller gastroesofageala övergången hos vuxna vars tumörer uttrycker PD L1 ≥ 1 enligt metoden CPS.
- KEYTRUDA i kombination med fluoropyrimidin och platinabaserad kemoterapi är indicerat som första linjens behandling av lokalt avancerad inoperabel eller metastaserad HER2-negativ adenokarcinom i ventrikel eller gastroesofageala övergången hos vuxna vars tumörer uttrycker PD-L1 ≥ 1 enligt metoden CPS.
Gallvägscancer
- KEYTRUDA i kombination med gemcitabin och cisplatin är indicerat som första linjens behandling av lokalt avancerad inoperabel eller metastaserad gallvägscancer hos vuxna.
Dosering och administreringssätt: Behandling ska initieras och övervakas av specialistläkare med erfarenhet av cancerbehandling. Om PD-L1-uttrycket specificeras i indikationen ska patienturvalet för behandling med KEYTRUDA baseras på tumöruttrycket av PD-L1, vilket bekräftas med en validerad testmetod. Om specificerat i indikationen ska patienturvalet för behandling med KEYTRUDA baseras på tumörstatus avseende MSI-H/dMMR, vilket bör bekräftas med en validerad testmetod.
Den rekommenderade dosen av KEYTRUDA för vuxna är antingen 200 mg var 3:e vecka eller 400 mg var 6:e vecka administrerat som en intravenös infusion under 30 minuter.
Den rekommenderade dosen av KEYTRUDA som monoterapi för pediatriska patienter från 3 år med cHL eller för patienter från 12 års ålder med melanom är 2 mg/kg kroppsvikt (upp till maximal dos på 200 mg), var 3:e vecka administrerat som en intravenös infusion under 30 minuter.
Patienter bör behandlas med KEYTRUDA till dess att sjukdomsprogression eller oacceptabel toxicitet inträffar (och upp till maximal behandlingstid om det är specificerat för en indikation). Det rekommenderas att kliniskt stabila patienter med initialt tecken på sjukdomsprogression ska stå kvar på behandling till dess att sjukdomsprogress har bekräftats.
För adjuvant behandling av melanom, NSCLC eller RCC ska KEYTRUDA administreras till och med sjukdomsrecidiv, oacceptabel toxicitet eller maximalt under ett års tid.
För neoadjuvant och adjuvant behandling av resektabel NSCLC ska patienter behandlas neoadjuvant med kemoterapi i kombination med 4 doser KEYTRUDA 200 mg var 3:e vecka, eller 2 doser med 400 mg var 6:e vecka, eller till sjukdomsprogression som omöjliggör komplett resektion, eller oacceptabel toxicitet. Detta följs av adjuvant behandling med 13 doser KEYTRUDA 200 mg som monoterapi var 3:e vecka, eller 7 doser 400 mg var 6:e vecka, eller till recidiv eller oacceptabel toxicitet. Patienter med sjukdomsprogression som omöjliggör komplett resektion eller som får oacceptabel toxicitet relaterat till KEYTRUDA i kombination med kemoterapi vid neoadjuvant behandling ska inte få KEYTRUDA som monoterapi för adjuvant behandling.
För neoadjuvant och adjuvant behandling av resektabel lokalt avancerad HNSCC ska patienter behandlas neoadjuvant med 2 doser KEYTRUDA 200 mg var 3:e vecka som monoterapi eller 1 dos med 400 mg eller till sjukdomsprogression som omöjliggör komplett resektion, eller oacceptabel toxicitet. Detta följs av adjuvant behandling i kombination med strålning med eller utan konkomitant cisplatin med 3 doser KEYTRUDA 200 mg var 3:e vecka eller 2 doser med 400 mg var 6:e vecka. Därefter ges 12 doser med KEYTRUDA 200 mg som monoterapi var 3:e vecka eller 6 doser med 400 mg var 6:e vecka, eller till recidiv eller oacceptabel toxicitet. Patienter med sjukdomsprogression som omöjliggör komplett resektion eller som får oacceptabel toxicitet relaterat till KEYTRUDA som monoterapi vid neoadjuvant behandling ska inte få KEYTRUDA i kombination med strålning med eller utan konkomitant cisplatin som adjuvant behandling.
För neoadjuvant och adjuvant behandling av TNBC ska patienter behandlas neoadjuvant i med kemoterapi i kombination med 8 doser KEYTRUDA 200 mg var 3:e vecka eller 4 doser med 400 mg var 6:e vecka eller till sjukdomsprogression som omöjliggör komplett resektion eller oacceptabel toxicitet. Detta följs av adjuvant behandling med 9 doser KEYTRUDA 200 mg var 3:e vecka eller 5 doser KEYTRUDA 400 mg var 6:e vecka som monoterapi eller till recidiv eller oacceptabel toxicitet. Patienter med sjukdomsprogression som omöjliggör komplett resektion eller som får oacceptabel toxicitet relaterat till KEYTRUDA i kombination med kemoterapi vid neoadjuvant behandling ska inte få KEYTRUDA som monoterapi för adjuvant behandling.
För lokalt avancerad cevixcancer ska patienter behandlas med KEYTRUDA i kombination med radiokemoterapi, följt av KEYTRUDA som monoterapi. KEYTRUDA kan administreras som antingen 200 mg var 3:e vecka eller 400 mg var 6:e vecka, till sjukdomsprogression, oacceptabel toxicitet eller i upp till 24 månader.
Vid administrering av KEYTRUDA som en del av en kombinationsbehandling med intravenös kemoterapi ska KEYTRUDA administreras först. Se även förskrivningsinformationen för kemoterapierna och övriga läkemedel som administreras i kombination med KEYTRUDA.
Vid administrering av KEYTRUDA som en del av en kombinationsbehandling med enfortumab vedotin ska KEYTRUDA administreras efter enfortumab vedotin när det ges samma dag.
Behandling med KEYTRUDA ska sättas ut permanent vid följande tillstånd:
- Immunmedierade biverkningar av grad 4 eller återkommande grad 3
- Pneumonit grad 3 eller 4, alternativt återkommande grad 2
- Kolit grad 4, alternativt återkommande grad 3
- Nefrit grad ≥ 3 med kreatinin >3 x ULN
- Hepatit grad ≥ 3 med ASAT eller ALAT >5 x ULN eller totalbilirubin >3 x ULN. OBSERVERA: för patienter med RCC som behandlas med KEYTRUDA i kombination med axitinib med förhöjda leverenzymer, se produktresumé.
- För patienter med levermetastaser som redan vid behandlingsstart har grad 2 förhöjning av ASAT eller ALAT och där ASAT eller ALAT ökar med ≥ 50 % under behandling och förhöjningen kvarstår ≥ 1 vecka
- Hudreaktioner grad 4 eller bekräftad Stevens-Johnsons syndrom (SJS) eller toxisk epidermal nekrolys (TEN)
- Myokardit, encefalit eller Guillain-Barrés syndrom av grad 3 eller 4
- Infusionsrelaterade reaktioner grad 3 eller 4
- Grad 4 immunmedierad toxicitet eller återkommande grad 3 med undantag av endokrinopatier som kontrolleras med hormonell substitutionsbehandling
- Om dosen kortikosteroid inte kan sänkas till ≤ 10 mg prednison eller motsvarande per dag inom 12 veckor
- Om en behandlingsrelaterad toxicitet inte återgår till grad 0-1 inom 12 veckor efter den senaste dosen av KEYTRUDA
Vid användning i kombination med lenvatinib ska ett eller båda läkemedlen avbrytas vid behov. Lenvatinib ska pausas, dosreduceras eller sättas ut i enlighet med förskrivningsinformationen för lenvatinib vid kombination med KEYTRUDA. Ingen dosreducering rekommenderas för KEYTRUDA.
Kontraindikationer: Överkänslighet mot den aktiva substansen eller mot något hjälpämne.
Varningar och försiktighet: För påvisande av tumörens PD-L1-uttryck är det viktigt att välja en validerad och robust metod för att minimera antalet falskt negativa eller falskt positiva utfall.
De flesta immunmedierade biverkningar som förekom under behandling med KEYTRUDA var reversibla och hanterades med uppehåll i behandlingen med KEYTRUDA, administrering av kortikosteroider och/eller understödjande behandling. Immunmedierade biverkningar har också debuterat efter den sista dosen av KEYTRUDA.
För biverkningar som misstänks vara immunmedierade bör lämplig utvärdering utföras för att bekräfta etiologin eller utesluta andra orsaker. För patienter vars immunmedierade biverkningar inte kunde kontrolleras med kortikosteroider kan, baserat på begränsade data från kliniska studier, andra systemiska immunsuppressiva läkemedel övervägas. Immunmedierade biverkningar som förekommit i samband med behandling inkluderar pneumonit, kolit, hepatit, nefrit och endokrinopatier.
Långvarig hormonell substitutionsbehandling kan vara nödvändig i fall av immunmedierade endokrinopatier. Allvarliga immunmedierade hudbiverkningar har rapporterats hos patienter som fått KEYTRUDA. Fall av SJS och TEN, vissa med dödlig utgång, har rapporterats hos patienter som fått KEYTRUDA. Om SJS eller TEN bekräftas ska KEYTRUDA sättas ut permanent. Ytterligare kliniskt signifikanta, immunmedierade biverkningar, inklusive allvarliga fall och fall med dödlig utgång, har rapporterats i kliniska studier eller efter godkännandet. Fall av graft-versus-host disease (GVHD) och hepatisk venös ocklusiv sjukdom (VOD) har observerats hos patienter med cHL som genomgått allogen hematopoetisk stamcellstransplantation (HSCT) efter tidigare exponering för KEYTRUDA.
Avstötning av organtransplantat har rapporterats efter godkännandet för försäljning hos patienter som behandlas med PD-1-hämmare. Behandling med KEYTRUDA kan öka avstötningsrisken hos organtransplanterade patienter.
Hos patienter som genomgått allogen HSCT har akut GVHD, inklusive GVHD med dödlig utgång, rapporterats efter behandling med KEYTRUDA. Till dess att ytterligare data blir tillgänglig, bör noggrant övervägande av de potentiella fördelarna med HSCT och den eventuella ökade risken för transplantationsrelaterade komplikationer göras från fall till fall.
Allvarliga infusionsrelaterade reaktioner, inklusive överkänslighetsreaktioner och anafylaxi, har rapporterats hos patienter som behandlats med KEYTRUDA.
KEYTRUDA i kombination med kemoterapi ska användas med försiktighet till patienter ≥ 75 år efter noggrant övervägande av det potentiella nytta-riskförhållandet på individuell basis. För användning av KEYTRUDA som adjuvant behandling av patienter med melanom har en trend mot ökad frekvens av svåra och allvarliga biverkningar hos patienter ≥ 75 år har observerats. Säkerhetsdata för KEYTRUDA som adjuvant behandling av patienter ≥ 75 år med melanom är begränsade.
Vid urotelial cancer ska läkaren innan insättning av behandling överväga den fördröjda effekten av KEYTRUDA hos patienter med sämre prognos som tidigare behandlats med platinabaserad kemoterapi. Vid användning av KEYTRUDA i kombinationsbehandling för patienter med NSCLC och HNSCC är de observerade biverkningsfrekvenserna högre, vilket speglar bidragen från var och en av komponenterna.
När KEYTRUDA ges med axitinib, har högre frekvenser än väntat rapporterats av förhöjda ALAT och ASAT av grad 3 och 4 hos patienter med avancerad RCC. Det saknas direkt jämförande studier av säkerheten för KEYTRUDA i kombinationsbehandling mot KEYTRUDA som monoterapi.
Kolangit och gallvägsrelaterade infektioner är inte ovanligt hos patienter med gallvägscancer. Patienter med gallvägscancer (speciellt de med stent i gallvägarna) ska därför undersökas för utveckling av kolangit eller gallvägsinfektion innan behandling påbörjas och regelbundet därefter.
Patientkort: Alla förskrivare av KEYTRUDA måste vara insatta i förskrivarformationen och behandlingsriktlinjerna avseende KEYTRUDA.
Förskrivaren måste diskutera riskerna med KEYTRUDA-behandling med patienten. Patienten ska förses med ett patientkort i samband med varje förskrivning.
Särskilda patientgrupper: Äldre; Ingen dosjustering behövs för patienter ≥ 65 år. Nedsatt njurfunktion; Ingen dosjustering behövs för patienter med lätt eller måttligt nedsatt njurfunktion. KEYTRUDA har inte studerats hos patienter med svårt nedsatt njurfunktion. Nedsatt leverfunktion; Ingen dosjustering behövs för patienter med lätt eller måttligt nedsatt leverfunktion. KEYTRUDA har inte studerats hos patienter med svårt nedsatt leverfunktion. Pediatrisk population; Säkerhet och effekt för KEYTRUDA för barn under 18 år har inte fastställts med undantag för pediatriska patienter med melanom eller cHL.
Biverkningar: KEYTRUDA förknippas oftast med immunmedierade biverkningar. De flesta av dessa, inklusive allvarliga biverkningar, gick i regress efter initiering av lämplig medicinsk behandling eller utsättande av KEYTRUDA.
Säkerheten för KEYTRUDA som monoterapi har utvärderats hos 7 631 patienter med olika tumörtyper med avseende på fyra doser (2 mg/kg kroppsvikt var 3:e vecka, 200 mg var 3:e vecka eller 10 mg/kg kroppsvikt varannan eller var 3:e vecka) i kliniska studier. I denna patientgrupp var de vanligaste biverkningarna trötthet (31 %), diarré (22 %) och illamående (20 %). Majoriteten av de biverkningar som rapporterades var av grad 1 eller 2 i allvarlighetshetsgrad. De allvarligaste biverkningarna som rapporterades för monoterapi var immunmedierade biverkningar och allvarliga infusionsrelaterade reaktioner.
Säkerheten för KEYTRUDA i kombination med kemoterapi, strålbehandling eller radiokemoterapi har utvärderats i kliniska studier omfattande 6695 patienter med olika tumörtyper som fick 200 mg, 2 mg/kg kroppsvikt eller 10 mg/kg kroppsvikt av KEYTRUDA var 3:e vecka. De mest frekvent förekommande biverkningarna var illamående (51 %), anemi (50 %), diarré (35 %), trötthet (35 %), förstoppning (32 %), kräkningar (27 %), sänkt antal neutrofiler
(26 %) och nedsatt aptit (27 %). Incidensen av biverkningar av grad 3-5 hos patienter med NSCLC var 69 % för kombinationsbehandling med KEYTRUDA och 61 % för enbart kemoterapi, för patienter med HNSCC var incidensen 80 % för kombinationsbehandling med KEYTRUDA (kemoterapi eller strålbehandling med eller utan kemoterapi) och 79 % för kemoterapi tillsammans med cetuximab eller strålbehandling med eller utan kemoterapi. För patienter med esofaguscancer var incidensen 86 % för kombinationsbehandling med KEYTRUDA och 83 % för enbart kemoterapi, och för patienter med TNBC var incidensen 80 % för kombinationsbehandling med KEYTRUDA och 77 % för enbart kemoterapi. För patienter med cervixcancer var incidensen 77 % för kombinationsbehandling med pembrolizumab (kemoterapi, med eller utan bevacizumab, eller i kombination med radiokemoterapi) och 71 % för kemoterapi med eller utan bevacizumab eller enbart radiokemoterapi. För patienter med ventrikelcancer var incidensen 74 % för kombinationsbehandling med pembrolizumab (kemoterapi med eller utan trastuzumab) och 68 % för kemoterapi med eller utan trastuzumab, och hos patienter med gallvägscancer var incidensen 85 % för kombinationsbehandling med pembrolizumab och 84 % för enbart kemoterapi, för patienter med endometriecancer var incidensen 59 % för kombinationsbehandling med pembrolizumab och 46 % för enbart kemoterapi, och för patienter med malignt pleuramesoteliom var incidensen 44 % för kombinations-behandling med pembrolizumab och 30 % för enbart kemoterapi.
Säkerheten för KEYTRUDA i kombination med axitinib eller lenvatinib vid avancerad RCC har utvärderats i kliniska studier med 1 456 patienter med avancerad RCC eller avancerad EC som fått 200 mg KEYTRUDA var 3:e vecka och antingen 5 mg axitinib två gånger dagligen eller 20 mg lenvatinib en gång dagligen, såsom lämpligt. I dessa patientpopulationer var de mest frekvent förekommande biverkningarna diarré (58 %), hypertoni (54 %), hypotyreos (46 %), trötthet (41 %), nedsatt aptit (40 %), illamående (40 %), artralgi (30 %), kräkningar (28 %), viktnedgång (28 %), dysfoni (28 %), buksmärta (28 %), proteinuri (27 %), palmar-plantar erytrodysestesi (26 %), hudutslag (26 %), stomatit (25 %), förstoppning (25 %), muskuloskeletal smärta (23 %), huvudvärk (23 %) och hosta (21 %). Incidensen av biverkningar grad 3-5 var 80 % för KEYTRUDA i kombination med antingen axitinib eller lenvatinib och 71 % för enbart sunitinib. För patienter med EC var incidensen av biverkningar grad 3-5 89 % för KEYTRUDA i kombination med lenvatinib och 73 % för enbart kemoterapi.
Följande mycket vanliga biverkningar rapporterades för ≥ 1 av 10 patienter:
Monoterapi: anemi, hypotyreos*, minskad aptit, huvudvärk, dyspné, hosta, diarré, buksmärta*, illamående, kräkning, förstoppning, hudutslag*, klåda*, muskuloskeletal smärta*, artralgi, trötthet, asteni, ödem*, pyrexi. Kombination med kemoterapi, strålbehandling eller radiokemoterapi: anemi, neutropeni, trombocytopeni, hypotyreos*, hypokalemi, minskad aptit, sömnlöshet, perifer neuropati, huvudvärk, dyspné, hosta, diarré, illamående, kräkning, buksmärta*, förstoppning, hudutslag*, alopeci, klåda*, muskuloskeletal smärta*, artralgi, trötthet, asteni, pyrexi, ödem*, förhöjt ALAT/ASAT. Kombination med axitinib eller lenvatinib: infektion i urinvägarna, anemi, hypotyreos, minskad aptit, huvudvärk, förändrad smakuppfattning, hypertoni, dyspné, hosta, diarré, buksmärta*, illamående, kräkning, förstoppning, hudutslag*, klåda*, artralgi, muskuloskeletal smärta*, myosit*, smärta i extremiteter, trötthet, asteni, ödem*, pyrexi, förhöjt lipas, förhöjt ALAT/ASAT, förhöjt blodkreatinin.
Följande vanliga biverkningar rapporterades för 1-10 av 100 patienter:
Monoterapi: lunginflammation, trombocytopeni, neutropeni, lymfopeni, infusionsrelaterad reaktion*, hypertyreos, hyponatremi, hypokalemi, hypokalcemi, sömnlöshet, yrsel, perifer neuropati, letargi, förändrad smakuppfattning, torra ögon, hjärtarytmi inklusive förmaksflimmer, hypertoni, pneumonit*, kolit*, muntorrhet, hepatit*, allvarliga hudreaktioner*, hudrodnad, dermatit, torr hud, vitiligo*, eksem, alopeci, akneliknande utslag, smärta i extremiteter, myosit*, artrit*, influensaliknande symtom, frossa, förhöjt ASAT/ALAT, hyperkalcemi, förhöjda alkaliska fosfataser (ALP), förhöjd nivå av bilirubin i blodet, förhöjt blodkreatinin. Kombination med kemoterapi, strålbehandling eller radiokemoterapi: lunginflammation, febril neutropeni, leukopeni, lymfopeni, infusionsrelaterad reaktion*, binjurebarksvikt*, hypertyreos*, tyreoidit*, hyponatremi, hypokalcemi, yrsel, förändrad smakuppfattning, torra ögon, hjärtarytmi inklusive förmaksflimmer, hypertoni, pneumonit*, kolit*, muntorrhet, gastrit, hepatit*, allvarliga hudreaktioner*, hudrodnad, dermatit, torr hud, akneliknande utslag, eksem, myosit*, smärta i extremiteter, artrit*, akut njurskada, influensaliknande sjukdom, frossa, förhöjd nivå bilirubin i blodet, förhöjt alkaliskt fosfatas (ALP), förhöjt blodkreatinin, hyperkalcemi. Kombination med axitinib eller lenvatinib: lunginflammation, neutropeni, trombocytopeni, lymfopeni, leukopeni, infusionsrelaterad reaktion*, binjurebarksvikt*, hypertyreos, tyreoidit*, hyponatremi, hypokalemi, hypokalcemi, sömnlöshet, yrsel, perifer neuropati, letargi, torra ögon, hjärtarytmi inklusive förmaksflimmer, pneumonit*, kolit*, pankreatit*, gastrit, muntorrhet, hepatit*, allvarliga hudreaktioner*, dermatit, torr hud, hudrodnad, akneliknande utslag, alopeci, artrit*, nefrit*, influensaliknande sjukdom, frossa, förhöjt amylas, förhöjda ALP, hyperkalcemi, förhöjd nivå bilirubin i blodet.
*) Dessa termer representerar en grupp av relaterade händelser som beskriver ett medicinskt tillstånd snarare än en enstaka händelse
När pembrolizumab administreras i kombination med enfortumab vedotin, se produktresumén för enfortumab vedotin innan behandlingen påbörjas.
Säkerheten för pembrolizumab i kombination med enfortumab vedotin har utvärderats hos 564 patienter med inoperabel eller metastaserad urotelial cancer som fick 200 mg pembrolizumab på dag 1 och 1,25 mg/kg enfortumab vedotin på dag 1 och 8 i varje 21-dagarscykel. Totalt sett observerades en högre incidens av biverkningar för pembrolizumab i kombination med enfortumab vedotin än för pembrolizumab som monoterapi, vilket återspeglar bidraget av enfortumab vedotin och den längre durationen av behandlingen med kombinationsbehandlingen. Biverkningarna liknade generellt de som observerats hos patienter som fått pembrolizumab eller enfortumab vedotin som monoterapi. Incidensen av makulopapulära utslag var 36 % av alla grader (10 % grad 3-4), vilket är högre än vad som observerats för pembrolizumab som monoterapi. Generellt var biverkningsfrekvenser högre hos patienter ≥ 65 år jämfört med < 65 år, särskilt för allvarliga biverkningar (56,3 % respektive 35,3 %) och biverkningar ≥ grad 3 (80,3 % respektive 64,2 %), vilket liknande observationerna för kemoterapi-komparatorn.
Immunogenicitet: I kliniska studier med patienter som behandlades med KEYTRUDA 2 mg/kg kroppsvikt var 3:e vecka, 200 mg var 3:e vecka eller 10 mg/kg kroppsvikt varannan eller var 3:e vecka som monoterapi hade 36 (1,8 %) av 2 034 utvärderbara patienter positiva testsvar för behandlingsinducerade antikroppar mot KEYTRUDA, varav 9 (0,4%) patienter hade neutraliserande antikroppar mot KEYTRUDA. Det fanns inga tecken på förändrad farmakokinetisk profil eller säkerhetsprofil vid utveckling av anti- KEYTRUDA eller neutraliserande antikroppar.
Interaktioner: Inga formella farmakokinetiska interaktionsstudier har utförts med KEYTRUDA. Eftersom KEYTRUDA elimineras från cirkulationen genom katabolism förväntas inga metabola läkemedelsinteraktioner. Användning av systemiska kortikosteroider eller immunsuppressiva läkemedel före start av KEYTRUDA bör undvikas på grund av potentiell påverkan på KEYTRUDA:s farmakodynamiska aktivitet och effekt.
Fertilitet, graviditet och amning: Det finns inga data från användning av KEYTRUDA hos gravida kvinnor. KEYTRUDA ska inte användas under graviditet såvida inte kvinnans kliniska tillstånd kräver behandling med KEYTRUDA. Fertila kvinnor ska använda en effektiv preventivmetod under behandling med KEYTRUDA och under minst 4 månader efter den sista dosen av KEYTRUDA. Det är okänt om KEYTRUDA utsöndras i bröstmjölk. Ett beslut bör fattas om man ska avbryta amningen eller avbryta behandling med KEYTRUDA efter att man tagit hänsyn till fördelen med amning för barnet och fördelen med behandling för kvinnan. Inga kliniska data finns tillgängliga avseende eventuella effekter av KEYTRUDA på fertiliteten.
Datum för översyn av produktresumé: 11/2025
För fullständig information se fass.se
SE-KEY-00106 10/2025








